生物质资源是一种污染小的可再生能源,可由其制得多种化工原料,如甲醛、甲醇和二甲醚等.
(1)甲醛溶液可用于浸制生物标本,这主要是利用了甲醛的何种化学性质
.
(2)由生物质能获得的CO和H
2,可以合成多种有机物.当CO和H
2以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是
.
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)工业上合成甲醇的反应:CO(g)+2H
2(g)?CH
3OH(g)△H=-90.8kJ/mol.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得
反应达到平衡时的有关数据如下:
| 1.容器 |
2.甲 |
3.乙 |
4.丙 |
| 5.反应物投入量 |
6.1molCO、2molH2 |
7.l molCH3OH |
8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) |
10.cl |
11.c2 |
12.c3 |
| 13.反应的能量变化 |
14.放出Q1kJ |
15.吸收Q2kJ |
16.放出Q3kJ |
| 17.平衡常数 |
18.Kl |
19.K2 |
20.K3 |
| 21.反应物转化率 |
22.al |
23.a2 |
24.a3 |
下列说法正确的是
.
A.cl=c2 B.2Q1=Q3 C.KI=K3 D.a2+a3<100%
(4)一定温度和压强下,CO和H
2催化合成二甲醚的反应为:
3H
2 (g)+3CO (g) CH
3OCH
3 (g)+CO
2(g)
若一体积可变的密闭容器中充入3mol H
2、3molCO、l mol CH
3OCH
3、l mol CO
2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.平衡时
n(CH
3OCH
3)=
mol.反应开始时正、逆反应速率的大小:v(正)
v(逆)(填‘‘>’’、“<”或“=”),理由是
.
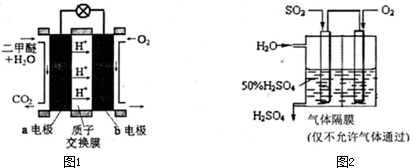
(5)如图1为绿色电源“直接二甲醚燃料电池”的工作原理示意图.b电极是
极,a电极的反应式为
.
(6)利用生物质资源过程中会产生SO
2,可利用如图2所示装置,用电化学原理生产硫酸为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO
2和水的质量比为
.


 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
