
题目列表(包括答案和解析)
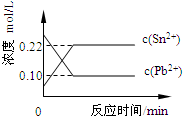 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )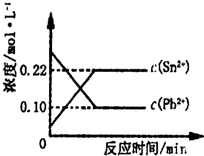 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H>0,体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H>0,体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
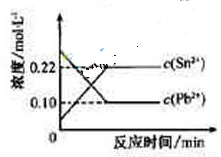
D.25℃时,该反应的平衡常数K=2.2
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
 体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.升高温度,平衡体系中c(Pb2+)增大
C.30℃时,该反应的平衡常数K>2.2
D.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(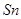 ),发生反应:
),发生反应: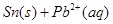

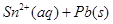 ,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
A. 往平衡体系中加入少量金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量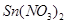 固体后,c(Sn2)变小
固体后,c(Sn2)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应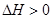
D. 25℃时,该反应的平衡常数K=2.2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com