
题目列表(包括答案和解析)
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
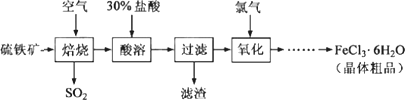
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为________.
2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为________.
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________、________.
(3)通氯气氧化后时,发生的主要反应的离子方程式为________;该过程产生的为其可用碱溶液吸收,为其中污染空气的气体为________(写化学).
(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: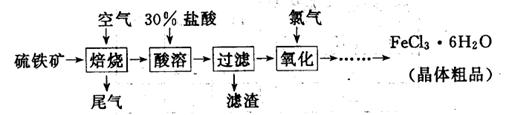
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。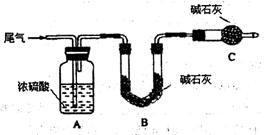
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .

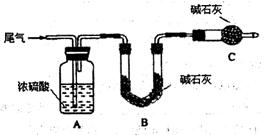
 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1) 在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
![]() (2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学式)。
(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)硫铁矿高温焙烧的化学方程式为 ; 少量的SO2与NaOH溶液反应的离子方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和 ,
题问所涉及反应的离子方程式为 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com