
题目列表(包括答案和解析)
| m | 2 |




| ||
| ||
| A、第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子 | B、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | C、第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | D、NH3、HNO3都是电解质,二者反应后的产物是离子化合物,含极性共价键和离子键 |
(15分)【化学——选修3:物质结构与性质】
Ⅰ.顺铂是美国教授B Rosenberg等人于1969年发现的第一种具有抗癌活性的金属配合物,它的化学式为Pt(NH3)2Cl2。
(1)与氮元素处于同一周期且相邻的两种元素分别是 ,这三种元素的第一电离能由大到小的顺序是 ,电负性由小到大的顺序是 。
(2)与NH3互为等电子体的分子、离子有 、 (各举一例)。
(3)碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物,其毒副作用低于顺铂。碳铂的结构如图:

碳铂分子中含有的作用力有 (填字母)。
A.极性共价键 B.非极性共价键 C.配位键 D.离子键
E.金属键 F. 键 G.
键 G. 键
键
(4)碳铂中C原子的杂化方式有 。
(5)铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中铂(Pt)原子的配位数为 。若已知铂(Pt)的摩尔质量为M g/mol,阿伏加德罗常数为NA,Pt原子半径为b pm,则该晶胞的密度为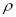 = g/cm3。(用含M、NA、b的计算式表示,不用化简)。
= g/cm3。(用含M、NA、b的计算式表示,不用化简)。
Ⅱ.原子序数小于36的元素A和B,在周期表中既处于同一周期又位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子,B元素在周期表中的位置为 ,A2+在基态时外围电子(价电子)占据的能层符号为 ,外围电子(价电子)排布式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com