
题目列表(包括答案和解析)
序号 | I1 | I2 | I3 | I4 | I5 | I6? |
电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
序号 | I7 | I8 | I9 | I10 | I11 | …… |
电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1 761 | …… |
根据以上信息回答:
(1)外层电子离核越远,能量越高,电离能越________(选填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越________ (选填“大”或“小”)。
(2)上述11个电子分属________个电子层。
(3)去掉11个电子后,该元素还有________个电子。
(4)该元素的最高化合价为________,最高价氧化物对应水化物的化学式是________。
电离能是指1 mol气态原子(或阳离子)失去1 mol电子形成1 mol气态阳离子(或更高价态阳离子)所需吸收的能量.现有核电荷数小于20的元素A,其电离能数据如下(I1表示原子失去第1个电子的电离能,In表示原子失去第n个电子的电离能.单位:eV):
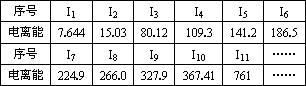
(1)外层电子离核越远,能量越高,电离能越________(填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越________(填“大”或“小”).
(2)上述11个电子分属几个电子层?________.
(3)去掉11个电子后,该元素还有________个电子.
(4)该元素最高价氧化物对应水化物的化学式是________.
 2NH3(g)
2NH3(g)

下图为细菌冶铜和火法冶铜的主要流程。

(1) 硫酸铜溶液一般呈________(填“酸”、“碱”或“中”)性,原因是________ (用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:______________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为________________(写出一点即可)。

(3) 用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?________(填“正确”或“不正确"),原因是__________
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:
CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是________(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量________固体于试管中,加入________使其溶解,再加入________溶液,观察现象。
④已知电解前,U形管中加入了________100mL0.5 mol . L-1 CuCl2溶液,电解结朿时电路中一共转移了 0.03 mol电子,且阴极生成0. 64 g铜,则形成的低价阳离子的物质的量为________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com