
题目列表(包括答案和解析)
 实验室中所用少量氯气是用下列方法制取的,
实验室中所用少量氯气是用下列方法制取的,
| ||
| ||
| ||
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O

试回答下列问题:
(1)该反应是氧化还原反应吗?① (填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是 ,③还原剂是 ,④写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
试回答下列中学化学实验室中的有关问题:
(1)下列仪器中:①分液漏斗;②试剂瓶;③集气瓶;④滴瓶;⑤托盘天平;⑥容量瓶;⑦量筒;标有使用温度的仪器有 。
(2)在仪器①漏斗;②容量瓶;③蒸馏烧瓶;④分液漏斗;⑤烧杯;⑥蒸发皿中,可用于粗盐提纯实验的有 ;可用于分离两种沸点接近且互不相溶的液态混合物实验的有 。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器 ①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶中,用到“磨砂”的有 。
(4)在一次实验中,学生需要使用1.0mol·L-1的NaOH溶液460mL,在实验室配制溶液时回答如下问题:
①使用托盘天平称取NaOH固体 g。
②误差分析:用字母填写A.偏大 B.偏小 C.无影响
Ⅰ.溶解后溶液未冷却至室温,就转移到容量瓶中,立即定容。则浓度 。
Ⅱ.定容时俯视液面,则浓度 。
(13分)实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
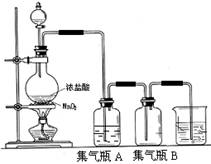
试回答下列问题:
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,用浓盐酸80mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了5.6L(标准状况下)的氯气。试计算浓盐酸的物质的量浓度和被氧化的HCl的物质的量。
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)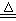 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗?① (填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是 ,③还原剂是 ,④写出该反应的离子 方程式 。
方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com