
题目列表(包括答案和解析)
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |
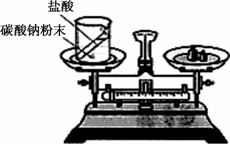
化学中质量守恒定律是一个非常重要的定量定律.
(1)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为m2,则(填“=”“>”“<”)m1________m2,其原因为________.
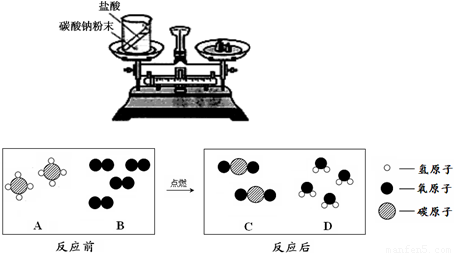
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料.燃烧反应前后分子种类变化的微观示意图如下所示.

①1个B分子中含有________个原子.
②四种物质中属于化合物的是________(填图中字母).
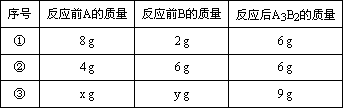
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量和都是10 g.有关实验数据见下表:
X∶Y的比值可能为________或________.
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案](1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
[进行实验]甲组同学:称取24.00 g样品,加水配成溶液,在溶液中加入过量的澄清石灰水.过滤、洗涤、干燥,共得到白色沉淀20.00 g.
乙组同学:称取24.00 g样品,加入足量的稀盐酸直到反应停止,共收集到8.80 g二氧化碳.
[解决问题]请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数.(写出计算过程.计算结果精确到0.1%)
________.

| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液,充分反应后过滤 | 产生白色沉淀 产生白色沉淀 |
有关反应的化学方程式为 Na2CO3+CaCl2=2NaCl+CaCO3↓ Na2CO3+CaCl2=2NaCl+CaCO3↓ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入 酚酞试液 酚酞试液 |
变红 变红 |
该样品中含有氢氧化钠 |
| 加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | 第七次 |
| 锥形瓶及所盛物质的总质量 | 95.00 | 120 | 145 | 170 | 192.8 | 215.6 | 240.6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com