
题目列表(包括答案和解析)
A.上层为紫色液体,下层为无色液体 B.上层为无色液体,下层为紫色液体
C.均为紫色液体 D.上层为橙色液体,下层为紫色液体
|
向盛有KI溶液的试管中加适量溴水和四氯化碳,振荡后静置,可见到的现象是 | |
A. |
上层为紫色液体,下层为无色液体 |
B. |
上层为无色液体,下层为紫色液体 |
C. |
均为紫色液体 |
D. |
上层为橙色液体,下层为紫色液体 |
| A、CCl4层显紫色是因为有I2生成 | B、CCl4层颜色变浅是因为I2变成I- | C、CCl4层显紫色是因为有Cl2生成 | D、CCl4层颜色变无色是因为I2的升华 |
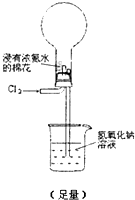 通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.
通过金属与盐溶液的置换反应可以比较金属还原性的强弱,通过非金属间的置换反应,也可以比较非金属氧化性的强弱.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com