
题目列表(包括答案和解析)
分析:H2SO4和BaCl2反应生成BaSO4和HCl,再用NaOH中和剩余H2SO4时,不能忽视NaOH又和生成HCl发生反应的这个隐蔽反应,而且这个反应是解题时不走弯路的关键。
【常规解法】(l)设BaCl2消耗H2SO4的质量为x,反应生成HCl的质量为y
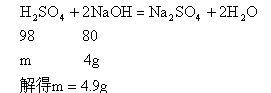 (2)设HCl消耗NaOH的质量为z
(2)设HCl消耗NaOH的质量为z
在反应中共消耗NaOH质量为32g×25%=8g,中和HCl用去4g,尚余4g
 (3)设4gNaOH中和的H2SO4质量为m
(3)设4gNaOH中和的H2SO4质量为m
硫酸中溶质的质量分数为
 答案:(略)
答案:(略)
【解法二】此题稍加分析,即可一步解出:用BaCl2的量不能求出H2SO4的量是因BaCl2不足量,而用NaOH的量却可求出H2SO4的量,因二者是完全中和的反应。之所以可用NaOH 而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
而H+并未参加反应,而H+却恰好被NaOH中和完全,所以可据与NaOH的中和反应求H2SO4的量。
设:H2SO4的量为x

硫酸中溶质的质量分数为 答案:(略)
答案:(略)
| ||

| ||
| ||

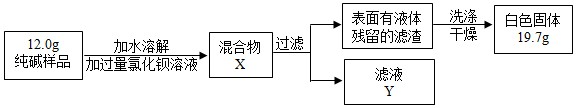
| 选择的装置 | 实验现象 | 实验结论 |
AB AB |
B中澄清石灰水不变浑浊 B中澄清石灰水不变浑浊 |
样品不含晶体A |
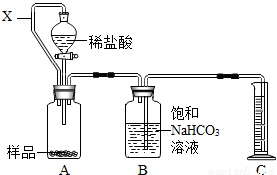
 NH3↑+HCl↑.
NH3↑+HCl↑.
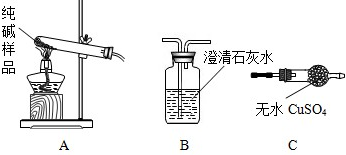
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |

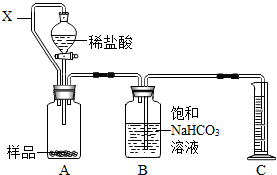 (2012?江宁区二模)为测定某药片中CaCO3含量,化学兴趣小组设计以下两种方案(药片中其他成分与HCl和NaOH溶液均不反应).请回答有关问题:
(2012?江宁区二模)为测定某药片中CaCO3含量,化学兴趣小组设计以下两种方案(药片中其他成分与HCl和NaOH溶液均不反应).请回答有关问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com