
题目列表(包括答案和解析)
氯化钠和硝酸钾两种物质的溶解度随温度的变化见下表:

请分析表格中的数据,回答下列问题:
(1)“20℃时氯化钠的溶解度为36.0 g”的含义是________.
(2)若两物质的溶解度相等,此时所对应的温度范围在________之间.
(3)从表中可以得到的一条信息是________.
(4)某同学欲从含有少量氯化钠的硝酸钾溶液中分离出硝酸钾,他应采取的方法是________.
(5)在20℃时,向100 g水中加入50 g硝酸钾,形成硝酸钾的________(填“饱和”或“不饱和”)溶液,将其温度升高到60℃时,溶液的质量为________g,该溶液中的溶质与溶剂的质量比为________.
| 温度/°C | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
| 温度/°C | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。
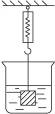
(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
| 密度/g·cm-3) | 1.01 | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
| 溶质质量分数/% | 1 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 98 |
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃—30 ℃)
| 温度/℃ 物质 | 0 | 10 | 20 | 30 |
| 氯化钠 | 35.7 g | 35.8 g | 36 g | 36.3 g |
| 碳酸钠晶体 | 7 g | 12.5 g | 21.5 g | 38.8 g |
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是:________________________________________________。
(2)由表二可得出两种物质溶解度差异的规律是:____________________________________。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠,那里的农民“冬天捞碱、夏天晒盐”。试说明其中的道理:__________________________________________________________。

(4)如图,烧杯内盛有不饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”)____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com