
题目列表(包括答案和解析)
 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.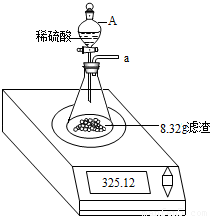



碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成。
(1)提出问题: 黑色固体是什么?
(2)猜想与假设: 黑色固体可能是:① ;②可能是炭粉;③可能是炭粉和氧化铜的混合物。请你补充猜想①。作出这些猜想的依据是 。
(3)实验方案: 他们称取了2.22g碱式碳酸铜在试管中高温加热使之完全分解,冷却至室温,称得黑色固体产物的质量为1.6g。
(4)实验反思:① 甲同学经过思考后,认为可以排除猜想③,理由是 (用化学方程式表示)。
② 乙同学根据质量守恒定律:化学反应前后,元素的种类和质量都不变。通过对得到的数据进行计算,排除了猜想②,他的理由是(通过计算式说明) 。
(5)实验结论:结合甲、乙同学的探究和查阅资料,丙同学确认只有猜想①成立。
(6)实验拓展:丙同学想进一步探究该黑色固体的化学性质。他发现实验室有一瓶无色溶液,其标签严重破损(如图),
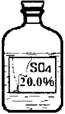
老师告诉他该瓶试剂是硫酸、硫酸钠或硫酸镁溶液中的一种。他通过查阅资料得知常温下这三种物质的溶解度如下表:
|
物 质 |
H2SO4 |
Na2SO4 |
MgSO4 |
|
常温下的溶解度∕g |
与水以任意比互溶 |
18.0 |
39.0 |
丙同学根据以上信息,分析此溶液一定不是 溶液。为确定其成分,他取了少量黑色固体放入试管中,然后向其中滴加了一定量的该无色溶液后,发现黑色固体全部消失,溶液由无色变为蓝色。他确定该溶液为 。其反应的化学方程式为 。
【解析】初中阶段常见的黑色物质有:氧化铜、碳、二氧化锰、四氧化三铁等.然后根据化学反应前后元素种类不变,进行分析确定物质组成,(4)①碳具有还原性,能够和金属氧化物发生氧化还原反应,所以碳和氧化铜不能同时存在,②2.22g碱式碳酸铜含碳元素的质量为12/222×22.2g=0.12g≠1.6g,
(6)由标签可知:溶液的质量分数是20%,题中给出三种物种的溶解度,根据溶解度计算,在该温度下,饱和溶液中的溶质的质量分数,分析不可能的是什么.可能是什么;硫酸铜溶液是蓝色的
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末。
【资料获悉】①铁系“脱氧剂”的作用原理是利用铁能被氧气氧化,从而达到除氧保鲜的目的。铁被氧气氧化最终产物为红棕色的Fe2O3(其他产物忽略不计)。
② Fe2O3+3H2SO4== Fe2(SO4)3+3H2O ;Fe + Fe2(SO4)3= 3FeSO4。
③“碱石灰的干燥管”可以用来干燥氧气、氢气等气体。
【探究目的】小组同学欲探究该“脱氧剂”是否已经失效,并测定10.00g样品各成分的质量,设计了以下探究实验。
【实验探究】(假设所有操作没有损失)
步骤1:小刚用磁铁接近样品,发现磁铁吸引了部分黑色固体。
步骤2:称取10.00g样品于一烧杯中,加足量水充分搅拌溶解后,过滤,将滤渣洗涤、干燥、称得其质量为8.32g。
 步骤3:按如右装置,将得到的8.32g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.11g。
步骤3:按如右装置,将得到的8.32g固体与足量稀硫酸反应,用电子秤称得反应前后总质量差为0.11g。
步骤4:将锥形瓶中反应后的液体过滤,并将滤渣洗涤、干燥后,称得其质量为1.20g。
步骤5:分析测算步骤4中所得滤液得知:滤液中溶质是硫酸和硫酸亚铁 ,且最后分离出16.72g硫酸亚铁。
【交流讨论】
(1)由步骤1得出的结论是 。
(2)步骤2目的是 。
(3)如果步骤4中滤渣没有经过洗涤,则称得的质量 1.20g(填“>”或“=”或“<”)
(4)小刚认为0.11g差值即为H2的质量,并由此计算出样品中单质铁的质量为3.08g。
小华提出在装置的a导管处应该再连接一个盛有碱石灰的干燥管,他这样做的理由
是
(5)小华还认真分析题中所给资料,他认为用产生H2的质量计算样品中铁的质量不合理。其理由是: 。
【学生实验】小华将步骤3的装置进行了改进,重新称取10.00g样品进行实验,并准确测得固体与足量稀硫酸反应前后总质量差为0.1g。
(6)请根据以上数据,计算10g该样品中各成分的质量。(只写出结果)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com