
题目列表(包括答案和解析)
23.有机物A、B、C具有相同的分子式。取14.8g有机物B在足量的氧气中燃烧,可生成CO2 0.6mol、H2O 10.8g,已知B的蒸气密度是相同条件下氢气的37倍。
(1)有机物A的分子式为___________,若A能与Na2CO3溶液反应产生气体,则A的结构简式为____________________。
(2)有机物B既能与NaOH溶液发生反应,又能在稀硫酸、加热条件下发生反应,生成两种相对分子质量相同的有机物,则B的结构简式这________________。
(3)有机物C中加入金属钠有气泡产生,加入银氨溶液,水强加热会产生银镜,结构测定分子中不含-CH3,则有机物C的结构简式为___________________,有机物C与O2在Ag作液化剂,加热条件下反应的化学方程式为________________________________________。
22.五种短周期元素A、B、C、D、E原子序数依次增大。A元素的最高正价与最低负价的代数和为2,B、E同主族,C元素原子核外电子占据六个原子轨道,且有1个未成对电子,D元素的原子的中子数比质子数多1,0.1mol D元素的单质与足量的稀H2SO4反应,产生的气体在标准状况下的体积为3.36L,E与C形成阴、阳离子个数比为1……2的化合物,推断并回答:
(1)元素D在周期表里的位置______________,E原子的电子排布式为_____________。
(2)A的单质的结构式_________________,用电子式表示A的氢化物的形成过程_______
_________________________。
(3)B元素原子的电子排布图__________________,A的第一电离能大于B的第一电离能的原因_____________________。
(4)D的最高价氧化物对应水化物与E的最高价氧化物对应水化物发生反应的离子方程式___________________________。
21.淀粉是绿色植物光合作用的产物,也是人类重要的食物之一。
(1)淀粉属于_______________(填写有机物类别)物质,在淀粉酶的作用下发生_________反应而生成葡萄糖,该反应的化学方程式为________________________________________。
(2)葡萄糖在工业上有着广泛的用途,列举两例____________________________________,葡萄糖在血液里称为“血糖”,葡萄糖在人体内发生氧化反应而释放能量,写出该反应的方程式_____________________________________________________________________。
(3)心脏病患者往往心血供应不足。为刺激心脏的收缩常使用心脏起搏器,用于该医疗电器的锂电池寿命可达十年以上。锂电池的负极材料是______________,电解质溶液_______(能、不能)用水溶液,锂电池寿命长的原因是______________________________________。
20.(12分) 某研究性学习小组的同学为测定含CaO杂质的CaC2试样中CaC2的纯度,设计了以下两种实验方案。请你参与他们的实验与研究:
Ⅰ:第一种方案
实验原理:根据生成乙炔气体的体积,测定CaC2试样的纯度。
实验操作:(1)用下图所示装置组合实验时,所选装置的连接顺序应是: (填各接口的字母)。
(2)若实验时称取的试样为1.40 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为 。
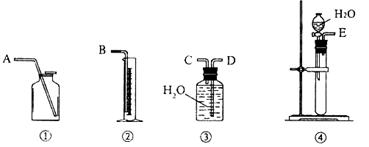 Ⅱ:第二种方案
Ⅱ:第二种方案
实验原理:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。
实验操作:先称取试样1.60 g,将试样加入锥形瓶中,称得锥形瓶和试样的质量为96.60g,再向锥形瓶中加入100 mL水,反应过程中每隔相同时间测得的数据如下表:
|
|
读数次数 |
质量/g |
|
|
第1次 |
196.30 |
|
第2次 |
196.15 |
|
|
锥形瓶十水十试样 |
第3次 |
196.05 |
|
|
第4次 |
196.00 |
|
第5次 |
196.00 |
(3)计算CaC2的质量分数时,必需用的数据是 。
(4)不必作第6次读数的原因是 。
Ⅲ:比较上述实验方案后,请你设计测定CaC2的质量分数的第三种方案。
(5)实验原理:___________________________________________________________。
(6)实验操作:___________________________________________________________。
19.下列实验方案的设计正确的是_______________(填序号)
A.在强酸、强碱反应的中和热测定中,把量筒中的NaOH溶液分几次缓慢倒入盐酸中
B.将碘酒滴到土豆上,可检验土豆中含有淀粉
C.煤干馏得到煤焦油的分离采用分馏的方法
D.利用浓硝酸遇蛋白质微热变黄色的性质,可对部分蛋白质进行检验
E.乙烷中混有乙烯,可先通入足量氢气,在Ni作催化剂条件下共热除去乙烯
F.除去乙酸乙酯中混有的乙酸,加入饱和Na2CO3溶液,振荡后,静置分液
18.某物质的分子组成为CxHyOz,取该物质m g在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,充分反应后,其固体的质量也增加m g,则该物质的分子组成必须满足
A.x=y=z B.x=y C. y=z D.x=z
第II卷(非选择题,共78分)
17.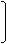

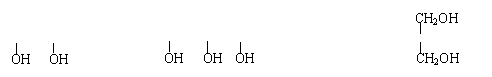 液态饱和多元醇都能与金属钠反应放出氢气,产生等质量的氢气消耗乙二醇、丙三醇、季戊四醇(结构简式如下)的物质的量之比为
液态饱和多元醇都能与金属钠反应放出氢气,产生等质量的氢气消耗乙二醇、丙三醇、季戊四醇(结构简式如下)的物质的量之比为
乙二醇 CH2-CH2 丙三醇 CH2-CH-CH2 季戊四醇 HOCH2-C-CH2OH
A.2∶3∶4 B.4∶3∶2 C.6∶4∶3 D.6∶3∶2
16.根据下列五种元素的电离能数据(单位:kJ/mol),判断下列说法不正确的是
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
A.元素的电负性最大的可能是Q元素 B.R和S均可能与U在同一主族
C.U元素可能在周期表的s区 D.原子的价电子构型为ns2np1的可能是T元素
15.为实施2008北京“科技奥运”战略,兴奋剂检测生物芯片将在2008年北京奥运会上首次“大显身手”。国际奥委会公布的违禁药物目前有138种,麻黄碱是禁止使用的兴奋剂之
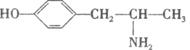
一,其结构简式如下: ,下列关于它的说法正确的是
A.它的分子式是C9H13NO B.该物质属于高分子化合物
C.从结构上看,它属于氨基酸 D.一定条件下可发生取代反应
14.下列有关反应式书写正确的是
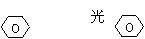 A.钢铁发生吸氧腐蚀的正极反应式:O2+2H2O+4e-===4OH-
A.钢铁发生吸氧腐蚀的正极反应式:O2+2H2O+4e-===4OH-
B.甲苯、氯气光照条件下发生侧链上的取代反应:2 -CH3+Cl2→2 -CH2Cl+H2
C.甲醇催化氧化的化学方程式:2CH3OH+O2 2HCHO+2H2O
D.醋酸与氢氧化铜反应的离子方程式:2H++Cu(OH)2===Cu2++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com