
题目列表(包括答案和解析)
|
N2+O2===2NO
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
|
|
(1)、环境问题是如何出现的?(1)、人类不当使用科学技术的结果
(2)、产生环境问题的根源是什么?(2)、极力追求商业利润
(3)、克服环境问题有哪些途径?(3)、治理,使用新技术,改变生活方式,环境意识教育
2.通过氧化还原反应实现含不同价态硫元素的物质之间的转化
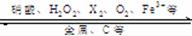
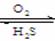
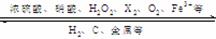 -2 0
+4
+6
-2 0
+4
+6
S S S S
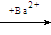 SO42-离子的检验:SO42- + Ba2+
= BaSO4↓
SO42-离子的检验:SO42- + Ba2+
= BaSO4↓
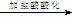 取少量待测液 无明显现象
产生白色沉淀
取少量待测液 无明显现象
产生白色沉淀
第二单元,生产生活中的含氮化合物
1.不同价态的硫的化合物
-2价:H2S、Na2S、FeS;+4价:SO2、H2SO3、Na2SO3
+6价:SO3、H2SO4、Na2SO4、BaSO4、CaSO4 、FeSO4
4.浓硫酸的强氧化性:
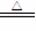 Cu
+ 2H2SO4(浓) CuS O4 + SO2↑+ 2H2O
Cu
+ 2H2SO4(浓) CuS O4 + SO2↑+ 2H2O
浓硫酸可以将许多金属氧化:金属 + 浓硫酸 → 硫酸盐 + SO2↑+ H2O
浓硫酸的氧化性比稀硫酸强:浓硫酸的强氧化性由+6价的S引起,而稀硫酸的氧化性由H+引起(只能氧化金属活动顺序表中H前面的金属)。
 C
+ 2H2SO4(浓) CO2↑+
2SO2↑+ 2H2O
C
+ 2H2SO4(浓) CO2↑+
2SO2↑+ 2H2O
3.浓硫酸的脱水性:浓硫酸将H、O按照2∶1的比例从物质中夺取出来,浓硫酸用作许多有机反应的脱水剂和催化剂。
2.浓硫酸的吸水性:浓硫酸具有吸水性,通常可用作干燥剂
1.硫酸的酸性:硫酸是二元强酸 H2SO4 = 2H+ + SO42- (具有酸的5点通性)
如:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 硫酸用于酸洗除锈
流程 设备 反应
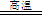
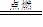 生成二氧化硫 沸腾炉 S + O2 SO2
或4FeS2
+ 11O2 2Fe2O3
+ 8SO2
生成二氧化硫 沸腾炉 S + O2 SO2
或4FeS2
+ 11O2 2Fe2O3
+ 8SO2
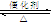 SO2接触氧化 接触室 2SO2 + O2
2SO3
SO2接触氧化 接触室 2SO2 + O2
2SO3
SO3的吸收 吸收塔 SO3 + H2O = H2SO4
* 为了防止形成酸雾,提高SO3的吸收率,常用浓硫酸来吸收SO3得到发烟硫酸
2.SO2的化学性质及其应用
⑴SO2是酸性氧化物
SO2
+ H2O  H2SO3
H2SO3
SO2 + Ca(OH)2 = CaSO3↓+ H2O;CaSO3 + SO2 + H2O = Ca(HSO3)2
SO2 + 2NaOH = Na2SO3 + H2O(实验室用NaOH溶液来吸收SO2尾气)
* 减少燃煤过程中SO2的排放(钙基固硫法)
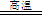 CaCO3 CaO
+ CO2↑;CaO
+ SO2 =
CaSO3
CaCO3 CaO
+ CO2↑;CaO
+ SO2 =
CaSO3
SO2 + Ca(OH)2 = CaSO3 + H2O
2CaSO3 + O2 = 2CaSO4
⑵SO2具有漂白性:常用于实验室对SO2气体的检验
漂白原理类型
①吸附型:活性炭漂白--活性炭吸附色素(包括胶体)
②强氧化型:HClO、O3、H2、Na2O2等强氧化剂漂白--将有色物质氧化,不可逆
③化合型:SO2漂白--与有色物质化合,可逆
⑶SO2具有还原性
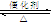 2SO2 + O2
2SO3
2SO2 + O2
2SO3
SO2 + X2 + 2H2O = 2HX + H2SO4
1.物理性质:无色、有刺激性气味、有毒的气体,易溶于水
* 大气污染物通常包括:SO2、CO、氮的氧化物、烃、固体颗粒物(飘尘)等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com