
题目列表(包括答案和解析)
6. 下列说法中正确是
A.周期表是按原子量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数相同
5.下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.气态单质分子中一定存在共价键
C.含有离子键的化合物一定是离子化合物
D.含有离子键的化合物不一定是离子化合物
4.下列各原子序数所表示的两种元素,能形成AB2型离子化合物的是( )
A.6和8 B.11和13 C.11和16 D.12和17
3.下列反应是吸热反应的是( )
A.铝片与稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳在O2中燃烧 D.甲烷在氧气中燃烧的反应
2.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的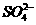 离子浓度逐渐增大
离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
1.下列关于 的叙述中,正确的是( )
的叙述中,正确的是( )
A.质子数为22 B.电子数为20 C.中子数为18 D.质量数为42
21.(10分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
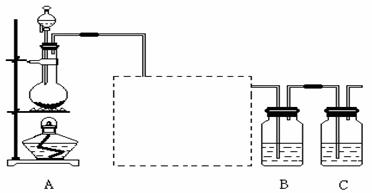
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因。 。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气。在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由
20.(12分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号:
X ,Y ,Z ,W
(2)X的单质和Z的单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。 E分子结构式为
(3)这四种元素可组成原子个数比为5:1:1:3的化合物(按X、Y、Z、W的顺序),含有化学键有 、 ,NaOH溶液反应的离子方程式为
19.(10分)Ⅰ.下图所示的虚线框中每一列、每一行相当于元素周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出元素周期表的第一至第六周期的轮廓,并画出金属与非金属的分界线。

Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M
与X、Y既不同族,也不同周期,X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X ,Y ,M 。
(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应: 。
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用
离子方程式表示) 。
18.(14分)下表是元素周期表的一部分,回答下列问题:

(1)写出①、②两种元素的名称____ , ____。
(2)写出⑧、⑨两种元素的符号____ , ____。
(3)在这些元素中,________( 用元素符号填写,下同)是最活泼的金属元素;________是最活泼的非金属元素;________是最不活泼的元素。
(4)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________。
(5)从⑤到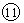 的元素中,________原子半径最小。
的元素中,________原子半径最小。
(6)比较⑤与⑥的化学性质,________更活泼,试用实验证明此现象(简述操作、现象和结论)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com