
题目列表(包括答案和解析)
23、(5分)某人血糖指标为 mmol·.L―1(4分)
某人血糖(填正常或异常) (1分)
22、(7分)(1)
(2分)
(2) (1分) (1分) (3)
(2分)
(4) (1分)
21、(每空1分共5分)(1)①
②
(2)A: B ;
(3)
20、(8分)(1)□Cu2S+□HNO3=□Cu(NO3)2+□H2SO4+□NO↑+□H2O
(配平2分 标电子转移1分共3分)
(2)(每空1分共3分) ; mol ; mol :
(3) mol。(2分)
19、(5分) (1分) (2分)
(1分) (1分)
18、(6分)
 内填物质类别, 上填化学式或物质名称
内填物质类别, 上填化学式或物质名称


17、(共6分)先加 (1分)再加
。(1分)
(2分) (2分)
24.(10分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10l kPa,温度为0℃)。
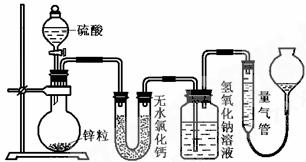
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,测得盛氢氧化钠溶液的洗气瓶增重l.28 g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g量气管中收集到VmL气体,则有方程:a g/65g·mol-1=b g/64g·mol-1+V mL / 22400 mL·mol-1,其依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,再加入V L c mol/L 浓硫酸,充分反应后锌有剩余,测得盛氢氧化钠溶液的洗气瓶增重m g,则整个实验过程产生的混和气体中H2和SO2物质的量之比 n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的比值将 (填
偏大、偏小或无影响)
黄冈中学2010年秋高一期中考试化学答题卡暨评分标准
2010/11/9
选择题每小题3分,共48分
|
1
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23.(5分)正常人血液中葡萄糖(简称血糖)为3.61~ 6.11(单位:mmol·.L―1),测得某人血液中血糖的质量分数0.1%,已知葡萄糖的相对分子质量为180设血液密度为1g·cm―3,通过计算判定某人血糖指标是多少?某人血糖是否正常?
22. (7分) 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(7分) 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
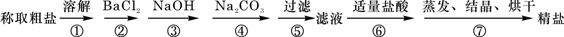
 (1)判断BaCl2已过量的方法是_________________________________。
(1)判断BaCl2已过量的方法是_________________________________。
(2)第④步中,有关的离子方程式是_____________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
_____________________________ 。
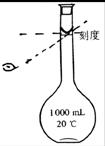
(4)为检验精盐纯度,需配制1000mL.0.2 mol/L NaCl(精盐)溶液,若定容时观察液面仰视(如右图所示),会造成所配制的溶液浓度(填偏高或偏低 )________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com