
题目列表(包括答案和解析)
27.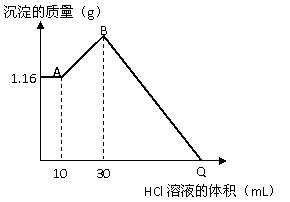 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,有1.16 g白色沉淀产生。在所得的悬浊液中逐滴加入1 mol/L HCl溶液,沉淀的总质量与加入HCl的体积的关系如右图所示。试计算回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量的水后,有1.16 g白色沉淀产生。在所得的悬浊液中逐滴加入1 mol/L HCl溶液,沉淀的总质量与加入HCl的体积的关系如右图所示。试计算回答:
注意:第(2)、(3)两小题要有简单计算过程,
否则不给分。
(1)A点沉淀物的化学式是____________,
B点沉淀物有_____________________
(多写少写均不得分)
(2)原混合物中MgCl2的质量是________ g,
AlCl3的质量是____________ g,NaOH的质量
是___________ g。
(3)Q点HCl溶液的体积是___________ mL。
附加题:(在前面得分不高时,计入总分,但计入后总分不得超过100分,共8分)
26.蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下
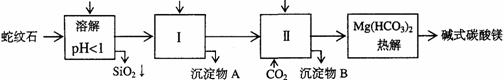
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是___________(多填少填均不得分)。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7-8
(有关氢氧化物沉淀的pH见右表)
Ca(OH)2不能过量,若Ca(OH)2过量
可能会导致_________溶解、_________沉淀。
(3)从沉淀混合物A中提取红色Fe2O3作颜料,先向沉淀物A中加入足量NaOH溶液,目的是除去沉淀物中可能存在的______________________(填化学式),然后_________、_________、__________、冷却 (依次填写实验操作名称)。
(4)18.2g产品aMgCO3·bMg(OH)2·cH2O完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:a∶b=__________,由此可推算c=_________。
25.硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治疗贫血的药效)。试设计一个方法,验证某硫酸亚铁药片是否已被氧化(主要步骤、现象、结论)。完成表格中的空白后回答问题。
|
主要步骤 |
现象 |
结论 |
|
1、将硫酸亚铁药片________(填操作名称) |
|
|
|
2、加入_______________溶液 |
|
|
(1)步骤1中常需要用到稀硫酸,主要目的是__________________________________。
(2)步骤2中若_______________现象,说明硫酸亚铁药片已被氧化;若_____________现象,说明硫酸亚铁药片未被氧化。
24.在硫酸铝、硫酸钾、硫酸铝钾三种物质组成的混合溶液中, SO42- 离子浓度为 0.2 mol/L, 加入等体积 0.2 mol/L 的氢氧化钾溶液(混合过程中溶液的体积变化忽略不计), 生成的白色沉淀恰好完全溶解, 则原混合溶液中K+ 的浓度为 ___ mol/L.
23.1986年化学家Karl Chrite首次用化学方法制得了氟气,他利用KMnO4为原料之一反应得到了制备氟气的中间产物K2MnF6,此反应的原料和产物还有H2O、O2、KF、HF。
(1)请从化合价变化来分析,补齐下列化学方程式,
□KMnO4 + □_____ + □______ → □K2MnF6 + □_______ + □H2O
(2)此反应中被氧化的元素是______________(填化学符号)
(3)当有1.5 mol电子转移时,参加反应的KMnO4的物质的量是___________ mol。
22.下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量从A--E中选择各题要求的序号填入表中
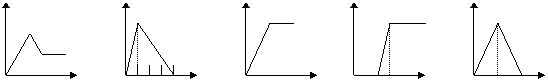
A B C D E
|
溶液 |
加入的物质 |
答案序号 |
|
饱和石灰水 |
通CO2至过量 |
|
|
AlCl3溶液 |
通过量的NH3 |
|
|
含少量NaOH的NaAlO2溶液 |
通过量的CO2 |
|
|
NaAlO2溶液 |
滴加稀HCl至过量 |
|
|
MgCl2 AlCl3的混和液 |
滴加NaOH至过量 |
|
21.近年来,我国储氢碳管研究获得重大进展,电弧法合成的碳纳米管,常伴有大量杂质--碳钠米颗粒。这种碳钠米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7+ H2SO4(稀) CO2+ K2SO4+ Cr2(SO4)3+
CO2+ K2SO4+ Cr2(SO4)3+
⑴ 完成并配平上述反应的化学方程式,并标出电子转移的方向和数目。
⑵ 此反应的氧化剂是 ,氧化产物是
⑶ H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
⑷ 上述反应中若产生11克气体物质,则转移电子的数目为 个。
20.将3.48 g四氧化三铁完全溶解在100 mL 1 mol/L的稀硫酸(硫酸足量),然后加入K2Cr2O7溶液25
mL,恰好将溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是(提示:Fe3O4可以写作FeO•Fe2O3,也可以将Fe3O4中Fe元素看作是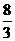 价来计算)··············· ( )
价来计算)··············· ( )
A.0.033 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
19.将1.12g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分反应后,其结果是 ( )
A.铁有剩余
B.往反应后溶液中滴入KSCN溶液,显红色。
C.Fe2+和Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
18.下列离子方程式正确的是····················· ( )
A.醋酸与氨水的反应: CH3COOH+NH3→CH3COONH4
B.氢氧化钡溶液与足量的硫酸溶液:
Ba2++2OH―+2H++SO42―→BaSO4↓+2H2O
C.氧化亚铁与足量的稀硝酸: FeO+2H+→Fe2++H2O
D.过量二氧化碳通入偏铝酸钠溶液中: CO2+2H2O+AlO2―→Al(OH)3↓+HCO3―
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com