
题目列表(包括答案和解析)
5、下列说法正确的是

 w_w w. k#s5_
w_w w. k#s5_
A、胶棉、蛋白质、醋酸纤维、硬脂酸钠、牛油都不属于酯类
B、现代材料科学所说三大合成材料是指塑料、粘合剂和涂料
C、区分植物油和矿物油的方法是加入足量的NaOH溶液共煮后,观察是否有分层现象
D、电离、水解、盐析、蛋白质变性都是不可逆的
4、下列各对物质互为同分异构体的是
①淀粉、纤维素②丁烯、丁二烯③蛋白质、氨基酸 ④蔗糖、麦芽糖⑤、硝基乙烷和甘氨酸
A、①②⑤ B、②③ C、①④ D、④⑤
3、下列事实能用同一原理解释的是

 w_w w. k#s5_
w_w w. k#s5_
A、丙烯酸和丙氨酸都能反应生成高分子化合物
B、溴苯中的Br2与苯中的苯酚都可以用NaOH溶液除去
C、乙醛、乙酸都能与新制Cu(OH)2悬浊液反应
D、CH2=CH-CH=CH2既能使溴水褪色,又能使酸性KMnO4溶都液褪色
2、 欲将蛋白质从水中析出而又不改变它的性质,应加入
A、(NH4)2SO4 溶液 B、酒精溶液 C、(CH3COO)2Pb溶液 D、AgNO3溶液
1、下列对糖类、油脂、蛋白质的叙述中,错误的是
A、光束通过蔗糖溶液时不能产生丁达尔现象
B、鸡蛋白发生盐析作用后失去了生理活性
C、蛋白质是组成细胞的基础物质,没有蛋白质就没有生命
D、油脂是比糖类和蛋白质热能高的营养成分,是重要的供能物质
24. (12分)等电子体原理是指两个或两个以上的分子(或离子),它们的原子数相同,分子(或离子)中价电子数也相同,等电子体具有相似的电子结构、几何构型和性质。
(1)SiO32-、SO3、NO3-三种粒子是等电子体,三种离子的几何构型为__________,其中Si、S、N三种基态原子的第一电离能大小关系为_____________________。
(2)C2O42-和 (分子)是等电子体,C2O42-离子具有较强的还原性,它能使酸性KMnO4溶液褪色,写出变化的离子方程式:
Mn原子在元素同期表中的位置是_ ____,外围电子构型为______。
(3)二原子14电子的等电子体共同特点是物质中都具有共价叁键,请举出相应的3个例子 (分子或离子)。每个分子或离子中含______个π键。
(4)过去常以SiO2为催化剂的载体。SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。
则一个硅的晶胞中有 个Si原子。再在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有 个O原子。
23. (6分)某钙钛型复合氧化物(如右图),
(6分)某钙钛型复合氧化物(如右图),
以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,
当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
 ⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,
则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: (用含x的代数式表示)
⑶下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
22.(8分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(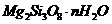 )等化合物。
)等化合物。
(1)某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
(2)铝元素的原子核外共有__ ___种不同运动状态的电子、_______种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:_____ _
(4)Al2O3、Mg0和SiO2都可以制耐火材料, 其原因是______。
a、Al2O3、Mg0和SiO2都不溶于水 b.Al2O3、Mg0和SiO2都是白色固体
c.Al2O3、Mg0和SiO2都是氧化物 d.Al2O3、Mg0和SiO2都有很高的熔点
21.(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子简化排布式为
。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0 弱酸,n=1 中强酸,n=2强酸,n=3 超强酸。
据实验事实可知硼酸(H3BO3)是弱酸,而亚磷酸是中强酸(H3PO3)
(1) 写出两种酸的结构式: 、 。
(2)写出亚磷酸过量的NaOH反应的方程式.
_____________________________________________________________________。
20.(12分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
 (1)E的基态原子的外围电子排布式为
。
(1)E的基态原子的外围电子排布式为
。
(2)下列叙述正确的是 。(填字母)
a.M易溶于水,是因为M与水分子间能形成氢键,且M
是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
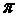
 c.N分子中含有6个 键和1个 键
c.N分子中含有6个 键和1个 键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧原子的配位数为 。
(4)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为 。
(5)某固体R的化学式为CA5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试完成下列问题。
①固体R的电子式为____________。
②R溶于水后有气体生成写出所发生的化学方程式___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com