
题目列表(包括答案和解析)
27.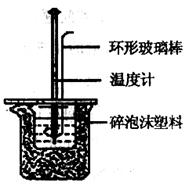 (8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1) 实验时用环形玻璃棒搅拌溶液的方法是 ,不能用铜丝搅拌棒代替环形玻璃棒的理由是 。
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实 验相比,所放出的中和热 (填“相等、不相等”)
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
26、(4分)
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_____________ 。
25、(10分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[ 入料V(N2)∶V(H2)=1∶3]
 NH3 压强/MPa NH3 压强/MPa的含量 /% 温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200℃ |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300℃ |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400℃ |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
500℃ |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
600℃ |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向 方向移动,正反应方向为 反应。
(2)根据平衡移动原理,合成氨适宜的条件是 。
A 高温高压 B 高温低压 C 低温高压 D 低温低压
(3)计算500℃,30MPa时N2的转化率 。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。
24.(共6分)在一定条件下,反应xA 十yB  zC达到平衡。
zC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x,y,z之间的关系是 。
(2)若C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则A的转化率将 (填“增大”、“减小”或“不变”)
(3)若A为固体,B、C为气体,且y>z,则增大压强时混和气体的平均相对分子质量将 (填“增大”“减小”或“不变”)
23.( 8分)(1)25℃时,0.1mol·L-1甲酸(HCOOH)溶液,写出其在溶液中的电离方程式 。
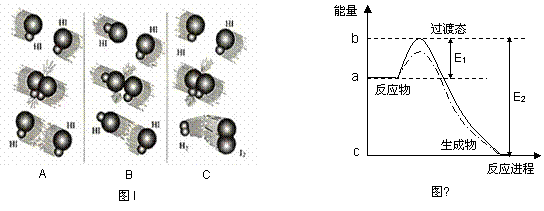 (2)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(2)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
a 、图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (选填“A”、“B”或“C”);
b、20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图(虚线图), 由此可知,过渡态理论认为,催化剂改变反应速率的原因是改变了反应的 ,降低了反应的 。
22.(5分)在水溶液中橙色的Cr2O72-与黄色的CrO42-有平衡关系:Cr2O72-
+ H2O  2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈 色。
(2)向已加入NaOH溶液的溶液中再加入过量稀硫酸,则溶液应是 色,因为 。
(3)向原溶液中加入 硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡 (向左移或向右移),溶液颜色将 。
21.将4 mol A气体和2 mol B气体在2L 的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 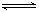 2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:( )
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:( )
① 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
② 用物质B 表示的反应的平均速率为0.6 mol•L-1•s-1
③ 2s时物质A的转化率为70%
④ 2s时物质B的浓度为0.7 mol•L-1 其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
第Ⅱ卷(非选择题,共58分)
20.影响化学反应速率的因素有多方面,如浓度、压强、温度、催化剂等。下列有关说法不正确的是
A.改变压强能改变气体反应的速率
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加反应体系中活化分子的百分数
D.催化剂能加快化学反应速率主要原因是降低反应所需的能量
19.将40℃的饱和石灰水加入少量CaO,但温度仍保持40℃,在这种情况下均未改变的是( )
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数、物质的量浓度
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目、pH
18.100℃时,将0.1
mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2
(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是(
)
2NO2
(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是(
)
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com