
题目列表(包括答案和解析)
3.甲、乙两元素原子的L层电子数都是其它层电子总数的2倍,下列说法正确的是( )
A.甲与乙处于同一周期 B.甲与乙处于同一主族
C.甲与乙的单质都是非金属 D.甲与乙的原子序数之和为偶数
2.下列各粒子的空间构型不一致的是( )
A.CO2与N2O B.CO32-与BF3 C.H2S与BeCl2 D.PO43-与NH4+
1.氢元素位于元素周期表中的第ⅠA族,按其结构与性质,也可以放在第ⅦA族,能支持此种说法的是( )
A.HCl B.NaH C.H2O2 D.H2
22.(1) (2分) (2) (2分)
(3) (2分) (2分)
(4) (2分) (2分)
21.(8分)(1) (2) (3)
(4)
稳定性: 理由: 。
沸点: 理由: 。
20.(1) (2) (3) (每空2分)
19. (1)(2分)
(1)(2分)
(2) (2分) (2分)
(3) (2分) (4) (2分)
(5)
(2分)
24.(7分)已知硫酸在水中的电离方程式是:H2SO4 ═ H+ + HSO4-
HSO4- H++SO42-,回答下列问题:
H++SO42-,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”)。理由是(用离子方程式表示) 。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有 。
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO42-)=0.029 mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO42-) 0.029 mol·L-1(填“<”,“>”或“=”),理由是 。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是:
。
(5)如果25 ℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11, 则25 ℃时,0.10 mol·L-1的H2SO4溶液中c(SO42-)= 。
湖北省黄冈中学2010年秋高二年级化学期末考试答题卡
第Ⅰ卷(选择题共54分)
第Ⅱ卷(非选择题 共54分)
23.(7分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6。M与其他物质的转化关系如下图(部分产物已略去):
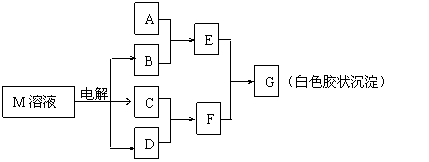
(1)工业电解M溶液的化学方程式为 。
(2)若A是X、Y同周期的一种常见金属,写出A与B溶液反应的化学方程式是 。
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为 ,写出E与F反应的离子方程式是 。
(4)B的电子式为:__________,其中的化学键类型为:______________。
(5)说明M物质的一种用途:___________ ______。
22.(12分)373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应:
 2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
2NH3(g) N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
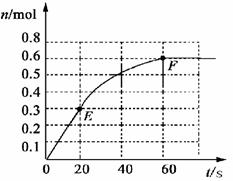
(1)前 20 s内NH3(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率 (填“增大”或“减小”,下同)。NH3的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3 的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com