
题目列表(包括答案和解析)
1.用化学方法不能实现的是
A.生成一种新分子 B.生成一种新离子
C.生成一种新核素 D.生成一种新单质
26.(10分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
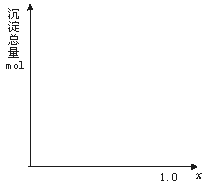
(1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随
x(0→1)变化的曲线。
(3)若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
常州市第一中学2004-2005学年第一学期第三次阶段测试
25.(8分)石青是自然界中的一种矿石,相对分子质量为346。取69.2g石青平均分成两份,将其中一份在氢气流中加热,最终得到19.2g红色粉末;将另一份加入足量的稀盐酸中,得到标准状况下的气体4480mL,该气体能使澄清石灰水混浊但不能使品红溶液褪色。通过计算推理,确定石青的化学式。
24.(12分)人们对于酸、碱的认识经历了一个由浅入深,由低级到高级的过程。1887年,Arrhenius,S.提出了酸碱电离理论:在水溶液中电离时产生的阳离子全部是H+的化合物叫酸、产生的阴离子全部是OH-的化合物叫碱。酸碱电离理论从物质的化学组成上揭露了酸碱的本质,在当时很好的解释了许多事实。然而,后来的研究表明酸碱电离理论也有局限性,如该理论把碱限制为氢氧化物等。1923年,Brфnsted-Lowry和Lewis,G.N.分别提出了酸碱质子理论和酸碱电子理论,质子理论认为:凡能给出质子的物质都是酸,凡能接受质子的物质都是碱;电子理论认为:凡是可以接受电子对的物质是酸,凡是给出电子对的物质是碱。
(1)能用酸碱电离理论解释的实验事实是 (选填序号)
A、氨水是一种碱 B、酸碱的中和热相同
C、无水乙醇有弱酸性 D、可以用pH衡量酸碱的强度
(2)酸碱质子理论认为,水是两性物质。请用化学方程式表示:
①水显酸性 ,
②水显碱性 ,
根据酸碱质子理论,磷酸的水溶液中显两性的物质有 ;
(3)有下列反应:BF3+F-=BF4-,从酸碱电子理论出发,该反应中的酸是 , F-和BF3形成BF4-过程的特点是 。
23.(8分)537 ℃、1.01×105 Pa时,往容积可变的密闭容器中充入2 mol SO2、l mo1O2,此时容器的体积为200 L 。向容器中加入催化剂(固体)并保持恒温恒压,发生反应:
2SO2(g) + O2(g)  2SO3(g) 达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
2SO3(g) 达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是: 。
(2)保持上述温度和压强不变,若向容器中只充入2 mol SO3 ,并加入固体催化剂。则平衡时,SO2的体积分数是 ,容器的体积为 L 。
(3)温度仍保持537 ℃,容器体积保持200 L不变(恒容)。充入a mol SO2、b mol O2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105 Pa。若a∶b=2∶1,则a = 。
22. (12分) 已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75℅,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的氢化物,X为无色液体。反应生成的水均已略去。它们有如下关系:
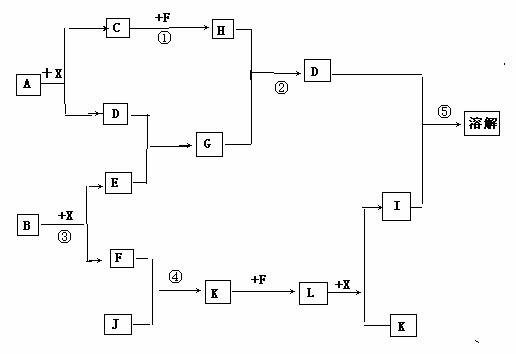
(1)写出化学式:A B J
(2)反应③中每生成1molF,转移电子的数目为
(3)反应④的化学方程式为:
(4)写出②离子方程式
21.(8分)A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的
液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、
Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
(1)C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式 。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式) ;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序 。
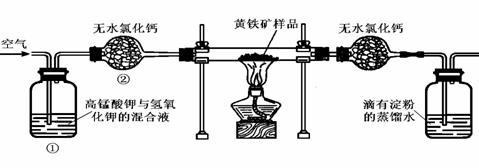
20、(12分)下图是某实验室测定黄铁矿中硫元素的质量分数的装置:
实验时有如下操作:
A. 将磁管中样品加热到800℃~850℃。 B. 称取研细的黄铁矿样品。 C. 连接好全部仪器,并检查其气密性。 D. 将样品小心放入硬质磁管中部。E. 以均匀的速度不断鼓入空气。F. 用标准碘溶液滴定含淀粉的SO2水溶液。
(1) 正确的实验步骤的次序是(以A、B┅的序号表示) 。
(2) 装置①的作用是 ;装置②的作用是 。
(3) 碘跟SO2水溶液反应的离子方程式为 。
(4) 根据 现象判断滴定已达到终点。
(5) 有同学认为用上述装置测出的黄铁矿中硫元素的质量分数通常将偏低,你是否同意该观点 (填是或否),请说出你的主要理由
(6) 假定矿样中的硫全部转化为SO2,并全部被水吸收。若称得矿样的质量为0.0900g,滴定管中碘溶液的初读数为1.10mL,末读数为25.60mL,标准碘溶液的浓度为0.0500 mol·L-1,则该黄铁矿样品中硫元素的质量分数为 。
19.(6分)(1) 白磷的着火点为40oC,在室温或夏天正常取出时,就可观察到其被氧化而冒“白烟”,请简单说明将如何将大块的白磷改变成小块的白磷。
答: (2)比较分析是化学学习中重要的学习方法,也是我们学习中解决问题的重要思想。某同学在进行镁铝性质实验时,发现用铝分别与H+浓度相同的稀硫酸和稀盐酸反应时,实验现象明显不同,在铝与硫酸的反应中,产生的气泡很少。从反应本质看,两者的实验现象应该相同。在不考虑实验条件、操作和药品纯度的情况下,请你对上述实验现象提出假设,并设计一简单的实验来验证你的假设。你的假设是 ,
实验操作和现象是 。
18. 铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
下列计算结果正确的是
A. ①中溶解了5.6gFe B.硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D.④中V=8960
第Ⅱ卷(共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com