
题目列表(包括答案和解析)
26、(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
 3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x= ,若平衡时,甲、乙两容器中A的物质的量不.相等,则x= 。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等 (填“相等”或“不相等”),平衡时甲中A的体积分数为 。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为 。
25、(10分)为测定钢铁中硫的含量,称取0.500g试样,高温下在氧气流中燃烧,使试样中的硫全部转化为二氧化硫。将燃烧后的气体通入加有淀粉指示剂的溶液中进行吸收,并用已知浓度的碘溶液进行滴定。
(1)滴定过程中发生反应的化学方程式是
(2)若到达滴定终点时,消耗VmL浓度为amol·L-1的碘溶液,则试样中硫的质量分数的计算式(请化简)为 。
(3)为了快速测定结果,配制一定浓度的碘溶液时,要使每消耗0.1mL碘溶液相当于试样中含硫0.001%。则该碘溶液的物质的量浓度应是多少?
24、(10分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1:1和1:2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B ,D
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)1molC的氢氧化物与1molB单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
23、(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
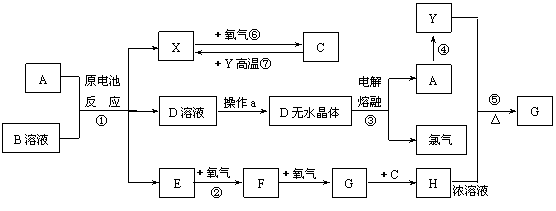 (注意:其中有些反应的条件及部分生成物被略去)
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
22、(10分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
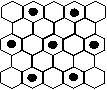
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
21、(8分)已知甲、乙、丙是前三周期元素的单质,A、B、C、D、E、F、C、X均为常见化合物;其中化合物B和X的摩尔质量相同,在一定条件下,各物质相互转化关系如下图所示:
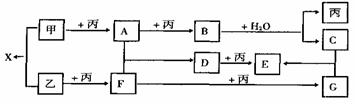
(1)写出X的电子式和C的化学式:X ,C 。
(2) 写出B+H2O反应的化学方程式 。
(3) 工业生产上F与丙反应的压强条件是
19、(8分)下面是中学化学实验中常见的几种定量仪器:
a、量筒b、容量瓶c、滴定管d、托盘天平e、温度计
(1)其中标示出仪器使用温度的是_____________(填写编号);
(2)实验时用来精确量取液体体积的是__________(填写编号);
(3)使用前要检查仪器是否漏液的是____________________(填写编号);
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_______________g。
20(共12分)、下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
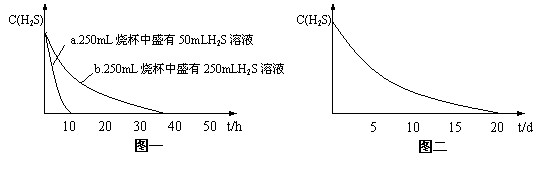
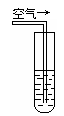
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸, 用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气
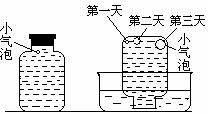 (1-2个气泡/min),数小时未见变浑浊的现象。实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
(1-2个气泡/min),数小时未见变浑浊的现象。实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_______________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_______的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)______________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是_________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
18、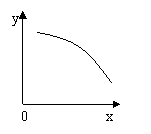 在一定条件下,固定容积的密闭容器中反应:2NO2(g)? O2(g) + 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
在一定条件下,固定容积的密闭容器中反应:2NO2(g)? O2(g) + 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示反应时间时,Y表示混合气体的密度
B、当X表示压强时,Y表示NO2的转化率
C、当X表示温度时,Y表示NO2的物质的量
D、当X表示NO2的物质的量时,Y表示O2的物质的量
第Ⅱ卷(非选择题 共76分)
17、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+7/2O2+14e-=14OH-。有关此电池的推断错误的是
A.通氧气的电极为负极 B.参加反应的O2与C2H6的物质的量之比为7∶2
 C.电池工作一段时间后,KOH的物质的量浓度将下降 D.在电解质溶液中CO32-向正极移动
C.电池工作一段时间后,KOH的物质的量浓度将下降 D.在电解质溶液中CO32-向正极移动
16、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Zn2+、SO B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH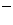 、SO
、SO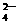
C.Ag+、K+、Cl-、H+、SO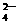 D.MnO
D.MnO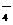 、NO
、NO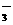 、SO
、SO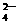 、OH-、Na+
、OH-、Na+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com