
题目列表(包括答案和解析)
22、(8分)北京时间10月15日9时42分,我国在酒泉卫星发射中心成功的发射了“神舟”五号载 人飞船。这标志着“炎黄子孙千年飞天梦想实现了,中国人的太空时代开始了。” ⑴ 火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高, 在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化 C.在常温下就分解气化 D.该涂料不可能发生分解 ⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2 O4 + N2H4 → N2 + H2O 。请配平该反应方程式: N2O4 + N2H4 = N2 + H2O 该反应中被氧化的原子与被还原的原子物质的量之比是 。 这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。 ⑶ 为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。① 写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似): ;
。 ② 你选择的供氧剂是: ,原因是: 。
22、(10分)有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是_________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是_________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是_______________________;反应过程中放出H2的速率依次为b1、b2、b3,则其关系是________________________。
21、(12分) 某学生有0.10mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度
(F)调节液面至0或0刻度以下,记下读数
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(D)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如俯视观察滴定管中液面刻度,则对滴定结果的影响是______________
21、(16分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后) →洗涤(并将洗涤液移入容量瓶)→ → →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量0.4克氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
|
实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
|
1 |
0.10 |
22.62 |
20.00 |
|
2 |
0.10 |
22.72 |
20.00 |
|
3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。


甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
20、(6分)下面a-e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填写编号,下同)
(2)能够用以精确量取液体体积的是
(3)由于错误操作, 使得到的数据比正确数据偏小的是
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶刚用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
19、pH=11的x,y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是 ( BC )
A、x、y两种碱溶液都是一元碱,则原两者溶液的物质的量浓度一定相等
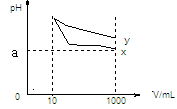 B、稀释后x溶液水电离的c(H+)比y溶液水电离的c(H+)大
B、稀释后x溶液水电离的c(H+)比y溶液水电离的c(H+)大
C、若9<a<1l,则x、y都是弱碱
D、完全中和x,y两溶液时,消耗同浓度盐酸的体积Vx>Vy
第Ⅱ卷(共82分)
18、 甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( A )
A.甲中由水电离出来的H+的物质的量浓度是乙中由水电离出来的H+的物质的量浓度的1╱10倍
B.物质的量浓度c(甲)=10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
D.甲中的c(OH-)为乙中c(OH-)的10倍
17、将7.84g铁粉加入200mL 2mol·L-1的HNO3溶液中,使之充分反应放出NO气体,所得
溶液中,主要离子浓度的大小关系符合下列的 ( A )
A.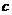 (NO
(NO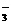 )>
)>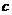 (Fe2+)>
(Fe2+)>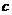 (Fe3+)>
(Fe3+)>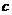 (H+)
(H+)
B.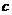 (NO
(NO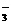 )>
)>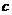 (Fe3+)>
(Fe3+)>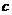 (Fe2+)>
(Fe2+)>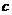 (H+)
(H+)
C.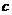 (Fe2+)>
(Fe2+)>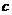 (Fe3+)>
(Fe3+)>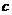 (NO
(NO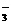 )>
)>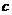 (H+)
(H+)
D.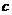 (Fe2+)>
(Fe2+)>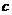 (NO
(NO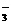 )>
)>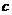 (Fe3+)>
(Fe3+)>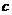 (H+)
(H+)
16、向NaBr、NaI、Na2SO3混合溶液中,通入一定量的氯气后,将溶液蒸干并灼烧,得到的剩余固体的组成可能是 (AB)
A. NaCl Na2SO4 B.NaCl NaBr Na2SO4
C. NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
15、某溶液中含有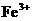 、
、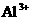 、
、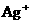 、
、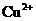 ,加入下列试剂,分别得到各含一种金属阳离子的沉淀.①通入
,加入下列试剂,分别得到各含一种金属阳离子的沉淀.①通入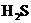 气体 ②通入
气体 ②通入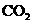 气体 ③加入盐酸 ④加入NaOH溶液.每次加入的试剂均过量且每次都把沉淀物滤出,其中实验操作的正确顺序是( B )
气体 ③加入盐酸 ④加入NaOH溶液.每次加入的试剂均过量且每次都把沉淀物滤出,其中实验操作的正确顺序是( B )
A、①③④② B、③①④② C、④②①③ D、④②③①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com