
题目列表(包括答案和解析)
5.下列有关物质结构的叙述,不正确的是 ( )
A.含有非极性键的分子不一定是非极性分子
B.氢化物的氢键与它的稳定性没有直接的关系
C.熔融状态时能导电的晶体一定是离子晶体
D.共价化合物中一定有极性键, 离子化合物中可能有非极性键
4.下列离子反应方程式正确的是
A.澄清石灰水来吸收氯气:Cl2+Ca(OH)2=Cl-+ClO-+Ca2++H2O
B.将金属Na加入冷水中:2Na+2H2O=2Na++2OH-+H2↑
C.向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.在少量的碳酸氢钙溶液中加入过量的苛性钾溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
3.在同温同压下,相同体积的甲、乙两种气体的质量比是11:7。若乙气体是C2H4,则甲气体可能是 ( )
A.N2O B.H2S C.O2 D.HCl
2.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
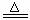 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是
A.KClO3是氧化剂在反应中被氧化 B.CO2是氧化产物
C.H2SO4在反应中做氧化剂 D.1 mol KClO3 参加反应失去2 mol 电子
1.2007年9月1日,经国务院批准,国家发改委等十七个部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围。下列有关做法不符合这一要求的是 ( )
|
B.在汽车上安装汽车尾气催化转化装置,使之发生如下反应:2CO+2NO 2CO2+N2
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在火力发电、核能发电和风力发电中,要大力发展火力发电
21.(13分)
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
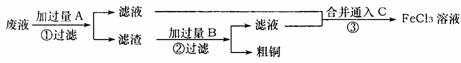
(1)写出一个能证明还原性Fe比Cu强的离子方程式____________________________,该反应在上图步骤___________中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
(2)分别写出上图步骤②、③相关反应的化学方程式:
步骤②_________________________________________________________________。
步骤③_________________________________________________________________。
(3)上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式_____________________________________________。
20.(9分)
下图所示转化关系中涉及的物质均由短周期元素组成(部分产物已略去),其中M由X、Y两种同周期元素组成,X原子的最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6。请填写下列空白:
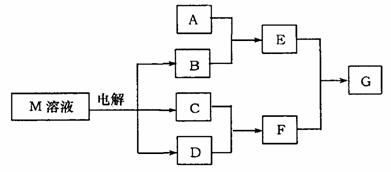
(1)若A是第3周期某一元素的氧化物,当F的水溶液过量时,G为可溶性盐,F的水溶液不足时,G为沉淀,则E与过量F反应的离子方程式为_____________。
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式为________________________________________________________________。
(3)若A是一种常见化肥,式量为79,且E与F反应生成G时,有白烟产生,则A 与足量B加热时反应的离子方程式为_________________________________。
19.(14分)
(1)常温下,将一定量CO2通人NaOH溶液中,二者恰好完全反应,得到只含一种溶质A的溶液,且pH>7,向该溶液中加人BaCl2溶液,生成白色沉淀B。B不可用作钡餐,若误用了B,可用5%的钠盐溶液C处理。请回答:
①用离子方程式表示A溶液pH>7的原因_______________________________。
②用离子方程式表示B不可用作钡餐的原因____________________________
③用离子方程式表示出误用B后可用C处理的原因______________________。
(2)在2L的密闭容器中,把3molA和4molB混合,在一定温度下发生反应:
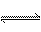 A(g)+2B(g) 2C(g)+2D(g)
A(g)+2B(g) 2C(g)+2D(g)
该反应2min后达到化学平衡,生成2molC,A的体积分数为ψ%。
回答下列问题:
①2min内A的化学反应速率为_________________________________________。
②此条件下该反应的化学平衡常数为___________,B的转化率为___________。
③若在相同条件下向该容器中充入amoLA、b molB、c mole、d molD,某时刻达到平衡,A的体积分数仍为ω%,则a与c满足的关系为___________________。
18.(8分)
A、B、C、D四种短周期元素,原子序数依次递增,A原子形成的阳离子就是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大。A、C、D三种元素可形成化合物甲,甲为中学化学常见物质。请回答:
(1)甲中所含化学键的类型为__________________________________________。
(2)已知乙是A、B两元素形成的最简单的有机化合物,依据乙在氧气中完全燃烧的反应设计成燃料电池,若以氢氧化钾溶液做电解质溶液,写出该电池的负极反应式。
(3)由A、B、C三种元素组成的化合物B:A6c在一定条件下可以转化为B2A4C, 现该转化的化学方程式______________________________________________________,B2A4C在一定条件下转化为B2A4C2。B2A6C和B2A4C2在一定条件下能发生反应,写出该反应的化学方程式_______________________________________________。
17.(12分)
某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为: Ca(ClO)2 +CaCl2+2H2SO4 CaSO4+2C12↑+2H2O,他们设计如下制取氯气并验证其性质的实验。
CaSO4+2C12↑+2H2O,他们设计如下制取氯气并验证其性质的实验。
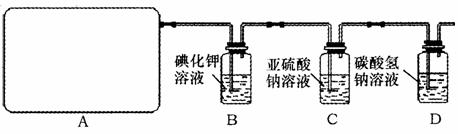
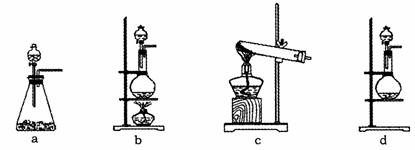
试回答:
(1)该实验中A部分的装置是________(填写装置的序号)。
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
(3)D装置中发生反应的离子方程____________________________________________。
(4)该实验存在明显的缺陷,请你提出改进的方法。
(5)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的Kl溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2====Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL。则该漂白粉中Ca(ClO)2的质量分数_________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com