
题目列表(包括答案和解析)
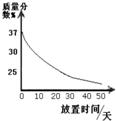
 25、小明和小华两同学进行盐酸与镁反应制取氢气的实验研究.小华用较稀的盐酸与镁反应,小明用较浓的盐酸与镁反应.他们分别取等质量的镁与足量盐酸在烧杯中反应,并从反应的开始每隔一段时间测定.烧杯中物质总质量随反应时间的变化情况如图所示.试回答下列问题:
25、小明和小华两同学进行盐酸与镁反应制取氢气的实验研究.小华用较稀的盐酸与镁反应,小明用较浓的盐酸与镁反应.他们分别取等质量的镁与足量盐酸在烧杯中反应,并从反应的开始每隔一段时间测定.烧杯中物质总质量随反应时间的变化情况如图所示.试回答下列问题: 17、小明和小华两同学进行盐酸与锌反应制取氢气的实验研究.小华用较稀的盐酸与锌反应,小明用较浓的盐酸与锌反应.他们分别取等质量的锌粒与足量盐酸在烧杯中反应,并从反应的开始每隔一段时间测定.烧杯中物质总质量随反应时间的变化情况如图所示.试回答下列问题:
17、小明和小华两同学进行盐酸与锌反应制取氢气的实验研究.小华用较稀的盐酸与锌反应,小明用较浓的盐酸与锌反应.他们分别取等质量的锌粒与足量盐酸在烧杯中反应,并从反应的开始每隔一段时间测定.烧杯中物质总质量随反应时间的变化情况如图所示.试回答下列问题:


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com