
题目列表(包括答案和解析)
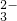 、SO
、SO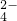 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
 +,其物质的量之比n(Mg2+):n(Al3+):n(NH
+,其物质的量之比n(Mg2+):n(Al3+):n(NH +)=______.
+)=______. -的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.
-的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.| A、Cl-可能存在 | B、Ba2+一定不存在 | C、K+一定存在 | D、溶液中CO32-浓度为0.1 mol/L |
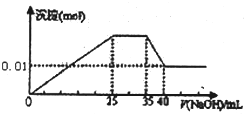 有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验| A、原溶液一定不存在H+、Cu2+、CO2-3 | B、不能确定原溶液是否含有K+、NO-3 | C、原溶液确定含Mg2+、Al3+、NH+4,且n(Mg2+):n(Al3+):n(NH+4)=1:1:2 | D、实验所加的NaOH的浓度为2 mol?L-1 |
一.选择题(48分)
1
2
3
4
5
6
7
8
9
10
11
12
B
A
A
D
C
D
A
D
B
A
B
B
13
14
15
16
17
18
19
20
21
22
23
24
D
C
B
B
A
D
A
C
B
B
B
A
25.(7分)略
26.(14分,每个方程式2分)
(1)Ar K (2 )KOH (3)Cl― Al3+
(4)H2O 2K+H2O==2KOH+H2↑
(5)黄 Cl2+2NaBr==2NaCl+Br2
点燃
(6)2Mg+CO2====2MgO+C
(7)Al2O3+2OH―====2AlO2―+H2O
27.(4分)x-8 x+18 x-18 x+8
28.(5分)250mL的容量瓶、烧杯内壁、容量瓶、胶头滴管、相切(各1分)
29.(10分,其中(3)4分,(4)2分,其余每空1分)
(1)乙 亚铁盐在空气中易被氧气氧化 (2) 还原
(3) 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 。
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理
(5) 未能测其成分。
三.计算题(12分)
30.(4分)(1)12 (2)27
31.(8分)(1)2min 末B的浓度为0.7mol?L-1 ,C的浓度为0.6mol?L-1 。
(2) 
 每个计算结果2分,本题共8分。
每个计算结果2分,本题共8分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com