
题目列表(包括答案和解析)
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
A.2Na+2H2O=2NaOH+H2↑ B.3Fe+2O2=Fe3O4
C.(NH4)2CO3=NH4HCO3+NH3↑ D.NaOH+HCl=NaCl+H2O
(3)实验室可以利用下图装置进行中和热测定。回答下列问题:

①请指出该装置还缺少的仪器是 ;
②两烧杯间填满碎泡沫塑料的作用是 ;
③若向三份等体积、等物质的量浓度的NaOH溶液中分别加入稀醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。则三者的大小关系是 (由大到小)。
化学反应中一定伴随着能量的变化,化学能在实际生产生活中的应用将越来越广泛。
(1)利用氢气可以制取工业原料乙酸。已知:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1 = -870.3kJ/mo1
②C(s)+O2(g)=CO2(g) △H 2= -393.5kJ/mo1
③H2(g) + 1/2O2(g)=H2O(l) △H 3= -285.8kJ/mo1
试利用上述信息计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= 。
(2)科学家可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的为 (填字母)。
| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |

| A.2Na+2H2O=2NaOH+H2↑ | B.3Fe+2O2=Fe3O4 |
| C.(NH4)2CO3=NH4HCO3+NH3↑ | D.NaOH+HCl=NaCl+H2O |


| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
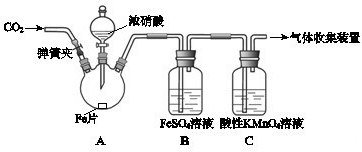
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com