
题目列表(包括答案和解析)
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。
请你按整套装置从左至右的顺序填写下表中的空格:
| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | | |
| C | | |
| C | 氢氧化钠浓溶液 | |
| C | | |
| D | | |
| E | | |
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。

请你按整套装置从左至右的顺序填写下表中的空格:
仪器符号 | 仪器中所加物质 | 装置作用 |
B |
|
|
C |
|
|
C | 氢氧化钠浓溶液 |
|
C |
|
|
D |
|
|
E |
|
|
(3)上述实验中能说明乙二酸受热分解生成了还原性气体的实验现象是________________________________________________________________。
(4)检验乙二酸具有较强的还原性,通常选用的试剂是_______________。

| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | | |
| C | | |
| C | 氢氧化钠浓溶液 | |
| C | | |
| D | | |
| E | | |

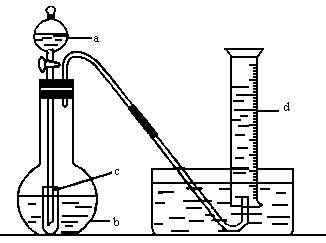
①用砂纸擦去镁条上的氧化膜并称重为Ag,将其放在反应器里。
②检查仪器装置的气密性。
③旋开a的活塞迅速放出适量稀H2SO4,立即关闭活塞。
④待镁条溶解后观察d中收集到气体的体积为B1mL,将其换算为标准状况下的体积为BmL。
(1)上述操作步骤的正确排序是(用编号)________________________________。
(2)镁条应放入的反应器是(用字母编号)________________________________。
(3)根据所得数据,镁的相对原子质量的表达式为________________________________。
(4)如果不擦去镁条上的氧化膜就进行实验,将会使测得镁的相对原子质量的值(“偏高”“偏低”“无影响”)________________________________。
(5)b中盛放的液体是水,其主要作用是________________________________。
1.(16分)
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)
|