
题目列表(包括答案和解析)
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
(1)计算聚氯乙烯中氯的质量分数。
(2)聚氯乙烯、聚乙烯的原料都为石油。其中,聚乙烯中的![]() 都来自于石油,而聚氯乙烯中的
都来自于石油,而聚氯乙烯中的![]() 除来自于石油外,还有HCl。现有1 t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)。
除来自于石油外,还有HCl。现有1 t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)。
(3)试根据上述信息及计算结果,谈谈该如何对待聚氯乙烯的使用。


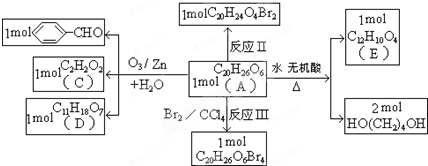
| O3/Zn+H2O |

| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
1.(16分)
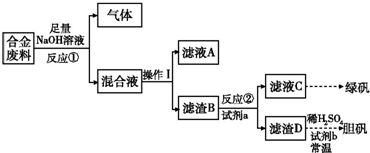
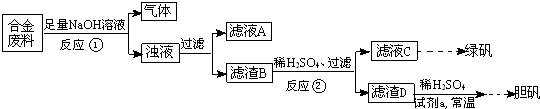
(1)①洗去油污(1分);③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤(1分);④将③的滤渣溶入足量的稀硫酸中,过滤,滤液保留待用(1分);(2)⑤、③(1分),将溶液加热到
(3)否(1分),普通自来水中含Cl―,使Ag+被沉淀(1分)。 (共2分)
(4)Fe+2Ag+
Fe2++2Ag,Fe2O3+6H+ 2Fe3++3H2O,Fe+2Fe3+ 3Fe2+,
Fe+2H+ Fe2++H2↑
(各1分,共4分)
(5)抑制Fe2+的水解,防止Fe2+被氧化 (2分)
2.(10分)(1)MnO2, NaOH溶液 (各1分) (共2分)
(2)2NaOH+Cl2==== NaCl+NaClO+H2O (2分)
(3)①不能(1分),HCl气体进入C中,消耗NaOH, 降低NaClO的纯度。(2分)(共3分)
|