
题目列表(包括答案和解析)
一种重要的药物中间体E的结构简式为: ,合成E和高分子树脂N的路线如下图所示:
,合成E和高分子树脂N的路线如下图所示:

已知:
① 
② 
请回答下列问题:
(1)合成高分子树脂N
① A中含氧官能团的名称为_____________。
② 由A可制得F,F的结构简式为___________________;F→G的反应类型为__________。
③ G有多种同分异构体,其中一种异构体X的结构简式为: ,下列有关X的说法正确的是___________(填标号)。
,下列有关X的说法正确的是___________(填标号)。
a.能与银氨溶液发生反应
b.能与氢气在一定条件下发生加成反应
c.在碱性条件下发生水解反应,1 mol X消耗2 mol NaOH
d.加热条件下,与NaOH醇溶液反应,只生成一种有机物
④ 写出M→N反应的化学方程式_______。
⑤ 已知碳碳双键能被O2氧化,则上述流程中“F→G”和 “H→M”两步的作用是__________。
(2)合成有机物E
① 写出C→E反应的化学方程式______________________。
② 实验室由C合成E的过程中,可使用如图所示的装置提高反应物的转化率。油水分离器可以随时将水分离除去。请你运用化学平衡原理分析使用油水分离器可提高反应物转化率的原因_________。

一种重要的药物中间体E的结构简式为: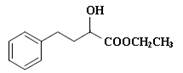 ,合成E和高分子树脂N的路线如下图所示:
,合成E和高分子树脂N的路线如下图所示: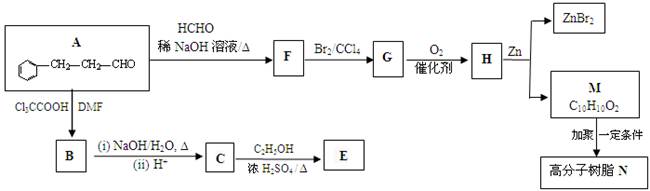
已知:
①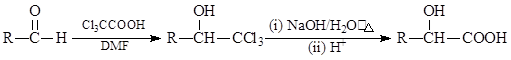
②
请回答下列问题:
(1)合成高分子树脂N
① A中含氧官能团的名称为_____________。
② 由A可制得F,F的结构简式为___________________;F→G的反应类型为__________。
③ G有多种同分异构体,其中一种异构体X的结构简式为: ,下列有关X的说法正确的是___________(填标号)。
,下列有关X的说法正确的是___________(填标号)。
a.能与银氨溶液发生反应
b.能与氢气在一定条件下发生加成反应
c.在碱性条件下发生水解反应,1 mol X消耗2 mol NaOH
d.加热条件下,与NaOH醇溶液反应,只生成一种有机物
④ 写出M→N反应的化学方程式_______。
⑤ 已知碳碳双键能被O2氧化,则上述流程中“F→G”和 “H→M”两步的作用是__________。
(2)合成有机物E
① 写出C→E反应的化学方程式______________________。
② 实验室由C合成E的过程中,可使用如图所示的装置提高反应物的转化率。油水分离器可以随时将水分离除去。请你运用化学平衡原理分析使用油水分离器可提高反应物转化率的原因_________。
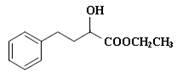 ,合成E和高分子树脂N的路线如下图所示:
,合成E和高分子树脂N的路线如下图所示: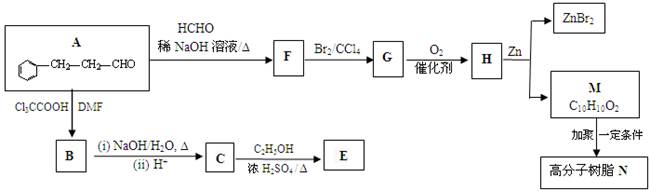
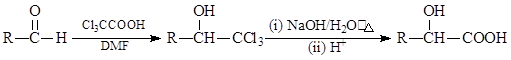
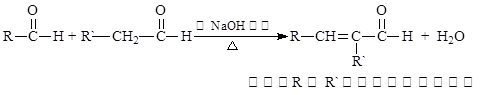
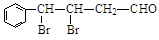 ,下列有关X的说法正确的是___________(填标号)。
,下列有关X的说法正确的是___________(填标号)。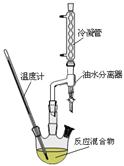
 芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO- -COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
芳香化合物A、B互为同分异构体,B的结构简式是 CH3COO- -COOCH2CH3 ,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号)_______________.
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰.
(2)E中含有官能团的名称是__________________.
(3)A有两种可能的结构,其对应的结构简式为________________、______________.
(4)B、C、D、F、G化合物中互为同系物的是_________________.
(5)F与H在浓硫酸作用下加热时发生反应的方程式为_________________________.
(14分)芳香化合物A、B互为同分异构体B的结构简式是CH3COO- -COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
-COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号) 。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰。
(2)E中含有官能团的名称是 。
(3)A有两种可能的结构,其对应的结构简式为 , 。
(4)B、C、D、F、G化合物中互为同系物的是 。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为:
。
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
C
C
A
D
B
B
D
A
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
题号
10
11
12
13
14
15
16
17
18
答案
BC
CD
B
BD
C
BC
B
C
C
三、(本题包括3小题,共34分)
19. (13分)
(1)甲 、乙 ;50mL碱式滴定管(每空1分,3分)
(2)D、E、F(3分,全对给分)。
(3)不能(1分) 量气管的最大量程是50mL,只需
(4)用标准卷尺量取镁带(2分) 12Va/5mx(2分)
20.(10分)
(1)Fe3O4也能被磁铁吸附,故不能由此确定X就是铁单质。(2分)
(2) ①检验是否存在Fe3+,确认Fe3O4的存在(2分) ②Fe+2 Fe3+=3Fe2+ (2分)
(3) ①过滤、洗涤(2分) ②n(Fe3O4)=0.01mol;n(Fe)=0.01mol(2分)
21、(11分)
(1)他们类比的物质是Na2SO4,而Na2SO4具有以下化学性质:与BaCl2溶液反应生成沉淀;Na2SO4溶液呈中性,且不与酸反应;Na2SO4无还原性,不能被氧化剂氧化,因此他们提出以上猜想。(2分)
(2)
实验操作
实验现象或
预期实验现象
现象解释
(用离子方程式表示)
结论
猜想②
操作一:用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照

操作二:用滴管取少量Na2S2O3溶液于试管,然后逐滴滴入3 mol?L-1H2SO4,振荡
有淡黄色沉淀和无色刺激性气味气体产生
猜想③
操作三:用滴管取少量新制氯水于试管,然后逐滴滴加少量Na2S2O3溶液,振荡
氯水颜色变浅
S2O32―+4Cl2+ 5H2O=2SO42―+8Cl―+10H+
(操作1分,现象1分,离子方程式2分,共7分)
(3)用滴管取少量反应后的溶液于试管,向其中滴入氯化钡溶液,若观察到有白色沉淀产生,则说明Na2S2O3能被氯水氧化(2分)
四、(本题包括3小题,共34分)
22.(14分)
(1)四,ⅦB(各1分,共2分)
(2) Zn+H2SO4=ZnSO4+H2↑(2分)
(3) ①H2O2 (2分)
②在酸性条件下加入双氧水,将Fe2+氧化成Fe3+ ,2Fe2++ 2H2O2+ 2H+ = 2Fe3++ 2H2O
调节pH至3.7-8.6,使Fe3+沉淀完全, Fe3++
3H2O  Fe(OH)3 + 3H+ (4分)
Fe(OH)3 + 3H+ (4分)
③以BaS为沉淀剂,使Pb2+、Cd2+、Hg+等金属离子,生成更难溶的硫化物而除去。(2分)
(4)MnSO4+2NH4HCO3 = (NH4)2 SO4 +MnCO3 + H2O + CO2↑(2分)
23(8分)
(1)①脱硫处理 (1分) ②2NO+2CO N2+2CO2(2分)
N2+2CO2(2分)
(2)①正四面体(1分)②4.57 (或4.6) (2分)③NH4++NO2?=N2↑+2H2O(2分)
24 (12分)
(1)0.1 mol/(L?min);(2分)
(2)0.17;(2分)
(3)A.C.D(2分)
(4)小于(1分),温度不变,平衡常数不变,若加入0.8 mol A 、1.0mol B平衡浓度则与上图1中A浓度相同,投入量相当于0.8 mol A 、1.0mol B后再投入0.1molB ,平衡向正向移动(2分)
 |
(5)(每线2分,共4分,
起点在第7分钟,拐点在第9分钟,降低温度的图像超越0.6mol/L给0分)
五、(本题包括1小题,9分)
25(9分)
(1)、C8H16O4 (1分)(2)BrCH2-CH2Br(1分) ;HO-CH2-CH2-Br (1分)
(3)酯化反应(2分)
(4)、nHOOC-CH2OH→ + nH2O
(2分)
+ nH2O
(2分)
(5)、D(2分)
六、选做题(本题包括2小题,每小题10分,考生只能选做一题)
26.(10分)
(1)C15H16O2(1分) (2)D (2分)
(3) (2分) (4)羟基、羧基;(2分) 消去反应(1分)
(2分) (4)羟基、羧基;(2分) 消去反应(1分)
(5)

 (2分)
(2分)
27.(10分)
(1)D(2分)
(2)F-H…F F-H…O O-H…F O-H…O(写对2个给1分,共2分)
(3) SO2 (1分), 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(2分)
(4) ZnO(2分);ZnO是原子晶体,而干冰是分子晶体。(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com