
题目列表(包括答案和解析)
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
|
生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。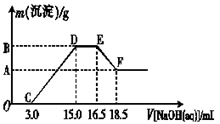
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |

| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
镁、铝、铁及其化合物在生产和生活中有广泛的应用.
1.镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2 mol/L稀硫酸中生成0.2 mol氢气,计算并确定镁铝合金中物质的量n(Mg)∶n(Al)=________.
2.硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10 g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4 g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为________.
3.现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是________.

4.炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况下).
(1)计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比).
(2)再取三份不同质量的上述钢样粉末分别加到100 mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为________.
(3)若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为________g.(保留3位小数)
1.A 2.B 3.D 4.A 5.A 6.B 7.B 8.C 9.D 10.C 11.A 12.C
13.(第一空2分,其余空各1分,共6分)
反应物原子间有电子转移 得 降低 还原 还原
14.(空各2分,共6分)②⑦ ①⑧ ④⑤
15.(方程式各3分,共6分)
(1)CaCO3 + 2H+ = Ca2++ 2H2O + CO2↑
(2)Cu2++ SO42- + Ba2++ 2OH-== Cu(OH)2↓+ BaSO4↓
16.(方程式各3分,共6分)
(1)Na2CO3 + 2HC1 = CO2↑+ H2O + 2NaC1
(2)AgNO3+ HC1 = AgC1↓+ HNO3
17.(每小题各2分,共8分) 略。
18.(空各2分,方程式各3分,共14分)
(1)Na2CO3、BaCl2、AgNO3、HCl
(2)CO32- + 2H+ = CO2↑+ H2O ; Ag+ + C1- = AgC1↓
19.(空各3分,共6分) 7.1 7.3
第二章 参考答案
1.B 2.A 3. B 4. C 5. C 6. D 7. C 8. D 9. C 10.B 11.A 12. A
13.银白; Na2O2; 黄; 软;2Na+2H2O=2NaOH+H2↑;(略);Fe3++3OH-=Fe(OH)3↓;
产生红褐色沉淀。
14.风化; 潮解; Na2CO3; 不变。
15.Na+>K+>Rb+; 还原; Rb、K、Na。
16.HCO3-+H+=H2O+CO2↑; 2OH-+CO2=CO32-+H2O; CO32-+H2O+CO2=2HCO3-
17.(1)ac (2)①FeCl3; 2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
②产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)Al(OH)3, Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O。
第三章 参考答案
16.18.4%
17.
第四章 参考答案
1.D 2.C 3.C 4.C 5.B 6.C 7.C
8.B 9.C 10.D 11.B 12.D 13.D 14.A
15.③④②①; ④③①②; ④③①②; ③②④①; ④③②①;
16.(1) E C D A B H G F
(2)MnO2+4HCl
(浓)  MnCl2+Cl ↑+2H2O
MnCl2+Cl ↑+2H2O
(3)①除去Cl3中的HCl气体 ②除去Cl2中混有的水蒸气
(4)Cl2+2OH-=Cl-+ClO-+H2O
17.(1)
第五章 参考答案
1.C 2.C 3.B 4.B 5.C 6.B 7.B 8.C 9.C 10.B
11.互为同位素 1:2:3 1:1:1 1:1:1
12.Na2O K2S MgF2 CaCl2
13.(1)A:氧 B:磷 C:硫 D:氯 E:铝
(2) A离子: C原子:
C原子:
(3) 极性
(4)先有白色沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
14.(1)A B
(2) ① Cl2+H2O = H+ + Cl‑ + HClO ② 略 ③ 2K2O2+2CO2=2K2CO3+O2
第六章 参考答案
1.B 2.B 3.D 4.D 5.B 6.A 7.B 8.B 9.C 10.D
11.
(1)氧化 (2)还原 (3)
12.(1)①如图配置

②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2)①溶液褪色 ②溶液褪色 ③有浅黄色沉淀(或溶液变浑浊)
(3)①NaSO3 变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再
滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
13. (1) O2
(1) O2
(2)C + 2H2SO4 (浓) 2SO2 + CO2↑+ 2H2O
(3)CO + 2H+
+ 2H+ CO2↑+
H2O SO2 + Cl2 + 2H2O
4H + + SO + 2Cl ?
+ 2Cl ?
第七章 参考答案
1.D 2.C 3.D 4.B 5.B 6.C 7.D 8.A 9.C 10.C 11.C
12. (1)a、c、d、e? (2)浓HNO3、水、块状大理石
13. (1)B装置中导气管长进短出
(2)①Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应;
③A、D
14.解:⑴ Cu+2H2SO4(浓) CuSO4
+SO2↑+2H2O ⑵Cu
CuSO4
+SO2↑+2H2O ⑵Cu H2SO4
H2SO4  CuSO4
CuSO4
6
⑶c(CuSO4)======0.2mol?L-1 答:(略)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com