
题目列表(包括答案和解析)
| 在“消防知识进校园”的讲座活动中,消防员叔叔告诉同学们:活泼金属(如镁、钙、钠)燃烧而引发的火灾不能用CO2灭火.爱动脑筋的小欣想:是不是活泼金属能与CO2反应呢?于是她取用了一个块金属钠和其它必要的药品及仪器(如下图所示),在老师的指导下并按下列步骤进行实验探究: | ||||||||
 | ||||||||
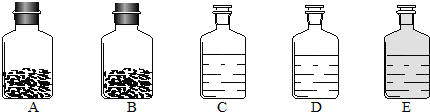
| (1)小欣制取并收集干燥的CO2应选用上图中的 _________ 装置(填序号). (2)小欣同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质. [提出问题]黑色颗粒和白色物质是什么? [老师提示]钠在二氧化碳中燃烧的生成物只有两种,黑色物质是单质碳,白色物质是一种化合物.钠在二氧化碳中燃烧生成的化合物到底是哪种物质?小欣做出了以下猜想:①是一种酸 ②是一种碱 ③是一种盐你认为猜想 _________ (填序号)一定是错误的,理由是 _________ . | ||||||||
(3)小欣同学对白色物质进行实验探究.
| ||||||||
| (4)钠在二氧化碳中燃烧的化学方程式为 _________ . (5)谈谈你对燃烧的一点新认识 _________ . |
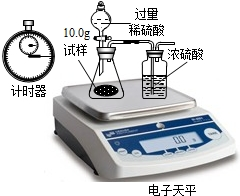
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.30 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 248.20 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 248.00 |
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
| 实验步骤 | 实验现象 |
| 取少量上层料液,滴加稀盐酸 | 无明显现象 |
| 另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
一、选择题(本大题有14小题,1~8题每小题2分,9~14题每小题3分,共34分)
题号
1
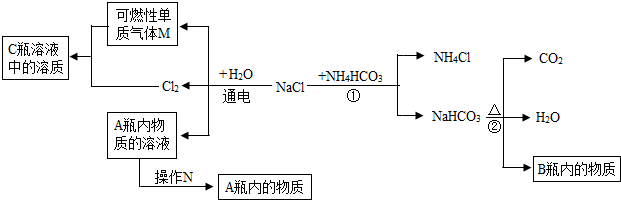
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
B
C
A
D
B
D
A
B
D
C
D
D
B
二、填空题(本大题有5小题,共24分)(以下除化学方程式2分外,其余每空1分)。
15.(4分) (1)E (2)A (3)D (4)B。
16.(3分)(1)硝酸见光易分解。
(2) ; 质量守恒定律,反应前后原子的种类和数目不变。
; 质量守恒定律,反应前后原子的种类和数目不变。
17.(7分)(1)19.00 , 20 。 (2)8; (3)BC (4)B;
(5) +
+ =
= +2
+2 。
。
18.(4分)镁片与盐酸反应比铁片与盐酸反应剧烈。
铜的金属活动性比汞强(或Cu>Hg); 铁(Fe); 盐酸(或氯化亚铁)等。
19.(6分)(1)导热性 (2)①2C4H10+13O2点燃8CO2+10H2O
②物理 ③方便添加燃料;便于灰渣的排出;有利于空气的流通(任答1点)
(3)使熄灭的外部火焰的气体的温度达到着火点
三、综合能力题 (本题有2小题,共18分)
20.(9分)(1)A、B、C分别为:NaOH、CuCl2、Na2CO3 或 NaOH、HNO3、Fe2O3
【说明:B物质对得1分,A与B、HCl全对得1分,C与B、HCl全对得1分;若B
物质错则不得分。填物质名称不得分。本题属开放性答案,其它合理答案也可】
(2)化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaOH+HCl==NaCl+H2O
[或2NaOH+CuCl2==Cu(OH)2↓+2NaCl或Na2CO3+CuCl2==CuCO3↓+2NaCl等]
【说明:所写化学方程式要与A、B、C三空对应,只有得分的物质,该化学方程式才能得分,否则不给分】
(3)酸与碱反应生成盐和水; 酸与盐反应生成新酸和新盐;(其它合理答案都给分)
21.(9分)(1)硫酸锌(1分); Fe(1分)。
(2) +
+ =
= +
+ (或
(或 +
+ =
= +
+ )(2分)
)(2分)
 +
+ =
= +
+ ↑(2分)
↑(2分)
(3)取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量。(1分)
(4)硫酸锌的质量、锌粉的质量。(2分)
四、实验与探究题(本题有2小题,共27分)
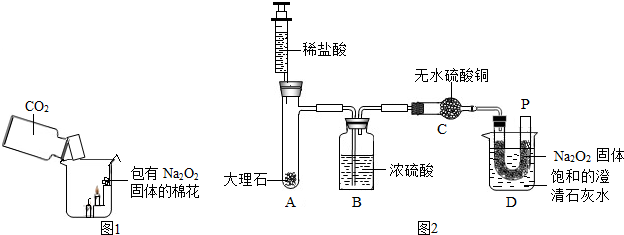
22.(化学方程式2分,共14分)
(1)①锥形瓶,②酒精灯;(2分)
(2)B, 2KMnO4 K2MnO4+MnO2+O2↑;
K2MnO4+MnO2+O2↑;
(3) 2Na2O2 + 2H2O = 4NaOH + O2↑ 2CaO2 + 2H2O = 2Ca(OH)2 + O2↑
g→f→i(对两个得1分,对三个得2分) CO2;(1分)
(4) 药品的状态和反应条件;(1分)
(5) 可随时加液体反应物,并通过滴加液体的快慢,控制反应的速率(1分)。
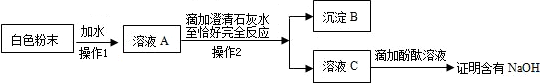
23.(13分)(1)(以下除化学方程式2分外,其余每空1分)。
白色粉末的成分
形成的原因
 +
+ =
= ↓+
↓+

 和
和 的混合物
的混合物
(2) 微溶于水(或可能是氢氧化钙)
微溶于水(或可能是氢氧化钙)
实验步骤
可能观察到的现象
结论
酚酞试液变红色
白色粉末中有
有气泡产生
有
 和
和 的混合物
的混合物
或
实验步骤
可能观察到的现象
结论
酚酞试液变红色
白色粉末中有
无气泡产生
无

或
实验步骤
可能观察到的现象
结论
酚酞试液不变色
白色粉末中无
有气泡产生
有

(3)交流与反思
①A和B(多选一个或漏选一个都不给分)
② +
+ =
= +
+ +
+ ↑(或
↑(或 +
+ =
= +
+ )
)
五、计算题(本题有2小题,共17分)
24.(7分)(1)③(1分); (2) ①396 (2分),② 84∶11∶4 (2分) (3) 50% (2分)
25.(10分)(1)4.4(2分)
(2) 、
、 (2分,答对一个给1分,有错项不给分)
(2分,答对一个给1分,有错项不给分)
(3)解:73g10%的稀盐酸中含HCl的质量是:73g×10%=7.3g
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y。
Na2CO3 +2HCl = 2NaCl +CO2↑ +H2O (1分)
106 73 117
x 7.3g y
 =
= x=10.6g
(1分)
x=10.6g
(1分)
 =
= y=11.7g
(1分)
y=11.7g
(1分)
烧杯里不饱和溶液中溶质的质量为:11.7g+(22.3g-10.6g)=23.4g (1分)
烧杯里不饱和溶液质量为: 22.3g+73g-4.4g=90.9g (1分)
烧杯里不饱和溶液中溶质的质量分数为: ×100%=25.7% (1分)
×100%=25.7% (1分)
答:略
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com