
题目列表(包括答案和解析)
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.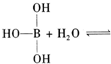
下列叙述正确的是( )
A.碳元素在反应中可以表现为-4价,而氧通常表现为-2价,所以碳元素的非金属性比氧元素强
B.碳族元素的化合价主要有+4和+2价,其中+4价化合物比+2价稳定
C.碳族元素包括非金属元素、两性元素、金属元素三种类型
D.碳有金刚石和石墨两种同素异形体,硅有晶体硅和无定形硅两种同素异形体
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式: 。
。
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。

A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式:
 。
。
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
D
C
C
B
B
二、选择题
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
D
C
D
B
D
D
A
C
三、选择题
题号
21
22
23
24
25
26
27
28
29
30
答案
BC
BD
BD
D
B
C
C
A
BC
BD
题号
31
32
33
34
答案
BC
B
AB
D
 四、填空、简答和计算
四、填空、简答和计算
 35. (1)
(2)
35. (1)
(2)
 |
(3)
(4)BaCO3+2H+==Ba2++CO2↑+H2O
 |
 (5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
(5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
36.(1)Li 原子失去一个电子后, Li+已经形成了稳定结构,此时再失去电子很困难。
(2) C ;(3) ⅢA族,失去第四个电子时所需能量远远大于失去前三个电子所需能量 。
37.(1)产生白色沉淀,试液变成红色;因为在水中SO2和Cl2反应生成盐酸和硫酸,使石蕊试液变红色,硫酸与BaCl2溶液反应产生BaSO4 沉淀。 (2)③、SO3;②、HCl;①、SO2;③、H2O。
38.(14分)(1)碳、氧、钠、硫(2)CO2+2OH-=H2O+CO32-
(3)
 。
。
39.⑴SiO2 Na2SiO3 H2SiO3
⑵

40.(1)
含有SO 或SO
或SO 中的一种或两种都有。
中的一种或两种都有。
(2) BaCO3;(3)
Br-、S2-
; HCO (除SO
(除SO 或SO
或SO 以外)
以外)
41.(1)Al;H2 ;Cl2(2)非金属;
(3)氧化物或氢化物;SiO2+ Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
42.(1) 、
、 ;
; (2)
(2) ;
; 、
、 (3)
(3) 、
、 ;
;
43.解: 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
(Y+16)g 2mol
∴ =
=
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
44.解:
由方程式可知: =n(被还原的
=n(被还原的 )
)


45. (1)a≤2/3;(2)a≥2; (3) 2/3<a<2, (1?a/2)mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com