
题目列表(包括答案和解析)
下列图1中B是一种常见的无色无味的液体。C是一种有磁性的化合物,E是一种无色无味的有毒气体。根据下列图1、图2,回答下列问题:
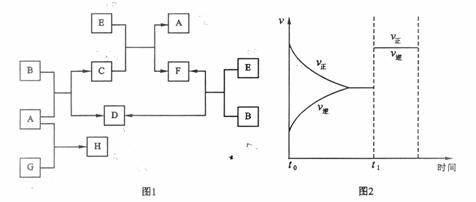
(1)写出C的化学式: 。
(2)E和N2是等电子体,请写出可能E的电子式:
(3)在101kPa和150℃时,可逆反应E(g) + B(g)![]() F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
F(g) + D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母) 。
A.升高温度 B.增大压强 C.加入催化剂
(4)若G是一种淡黄色固体单质,16 g G和足量的A反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式: 。
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式: ;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因:
下列表示分子结构的图示中,●表示短周期的几种元素的“原子实”[指原子除去最外电子层电子后剩余的部分,周围小黑点表示没有用于形成共价键的最外层电子,短线代表共价键。例如X2 (X代表卤素原子):![]()

回答下列问题:
(1)A、B、C、D四种“图示”中,所表示的物质可分为四组共_________种分子。这些物质的分子中的电子总数可能为________或________。
(2)分子的空间构型为正四面体的物质的分子式是________________。该组中,物质的稳定性顺序是________________;它们沸点的变化与其余各组相比________________(填“相同”或“不相同”),其原因是 ________________________________________ 。
(3)
写出上述物质中的两种间相互反应生成离子化合物的化学方程式:__________________ 。
(12分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
⑴D的化学式为 ▲ ;F的电子式为 ▲ 。
⑵A与B生成D的反应在工业上是生产 ▲ 的反应原理之一。
⑶E与G的稀溶液反应的离子方程式为 ▲ 。
⑷B和C反应的化学方程式为 ▲ 。
⑸J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 ▲ 。
(10分)下列所述各微粒都是由短周期元素组成的。
(1)由两种短周期元素组成的A、B两种分子,分子中电子总数均为18且相对分子质量相同。若A、B能发生氧化还原反应,生成黄色固体单质。请写出该反应的化学方程式 ;反应中若生成1mol该单质,则转移电子的个数为 。
(2)有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。W与Z同周期;W和Y不属于同一主族;Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层电子数比Z元素的最外层电子数多5个电子。请写出由Z、W两种元素组成的化合物的电子式 。由X、Y按原子个数比为1:1组成的化合物的电子式 。
(3)由X和Y两元素可形成C+、D-、E三种微粒(分子或离子),它们都分别含有10个电子,已知它们有转化关系D-+ C+=2E;请写出与微粒D-原子种类和个数完全相同但不带电的另一种微粒的电子式 。
(6分)下列框图题中,已知A、E、F、H是单质,其中只有A是一种常见的金属单质,其它都是气体,且H是呈黄绿色;B是最常见液体,C是一种淡黄色粉末,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。
回答下列问题:
(1)写出C化学式: I的电子式 ;
(2)写出离子方程式:
K+H: ;
(3)写出化学方程式:
B+C: ;
一、选择题
1D,
二、填空题
21.(12分)
(1)A:碳 B:氮 C:氯 (各1分)
(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)NCl3 (1分)极性键(1分) NCl3+ 3H2O=NH3+3HClO (2分)
(4)C3N4 (1分)因为N的原子半径比C的原子半径小,键长更短,所以C3N4的硬度比金刚石硬度大。(2分)
三、实验题
22.(12分) (1)c (1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液; (Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));
(Ⅲ)过滤 (每空1分,共3分)
②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
四、推断题
|