
题目列表(包括答案和解析)
氧族元素的各种性质可归纳整理出如下(部分):

回答下列问题:
(1)硒的原子结构示意图为________.
(2)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:________.
(3)碲的主要化合价可能有________.
(4)工业上可用Al2Te3制备H2Te,化学方程式为:________.
(5)下图所示为上述氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应过程中的能量变化(反应的热效应).则:b代表________,d代表________(写化学式).
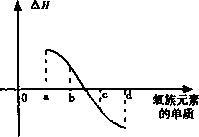
| |||||||||||||||||||||||
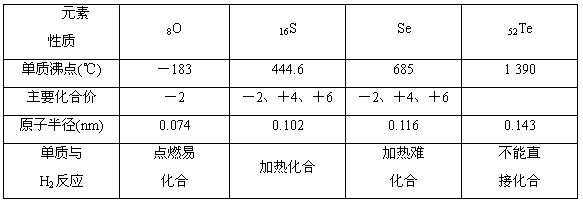
(10)氧族元素的各种性质可归纳整理如下(部分):
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 |
|
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
回答下列问题:
(1)氧离子的结构示意图为 ,硫离子的电子式为 。
(2)碲的主要化合价可能有 。
(3)氧元素比硫无素非金属性 (填强和弱)。请用化学方程式证明该结论:
(4)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
(10)氧族元素的各种性质可归纳整理如下(部分):
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
一、单项选择题(本题包括16小题,每小题3分,共48分)
1、B 2、D 3、B 4、A 5、D 6、A 7、A 8、C
9、B 10、A 11、C 12、B 13、B 14、B 15、B 16、D
二、(本题包括2小题,共40分)
17。(3分)①②⑤⑥
18.(13分)(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率(2分)
(2)①没道理,因为H2本身难溶于水(2分)
②(2分)
将铜片加入稀硫酸中,并微热
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(5分)
白色沉淀是氯化亚铜
向白色沉淀中加入稀HNO3等强氧化剂
溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾溶液
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
 (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
19.(12分)
(1) (2分)
(2分)
(2)Cl2+H2O2==2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O==2Al(OH)3↓+3H2Te↑(或其它合理答案(2分)
(5)Se(2分)O2(2分)
20.(12分)(1)使Al3+、Fe3+完全沉淀(2分)
(2)Ca2++(NH4) CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各2分,共4分)
三、(本题包括1小题,共12分)
21。⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x =
 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) =
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(各2分,共12分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com