
题目列表(包括答案和解析)
C.小于0.037 nm D.无法确定
有关元素X、Y、Z、W的信息如下:
| 元素 | 有关信息 |
| X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
| Y | 原子半径为0.102 nm,其原子核外电子排布为: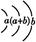 |
| Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W | 所在主族序数与所在周期序数之差为4 |
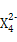 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。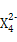 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。有关元素X、Y、Z、W的信息如下:
元素 | 有关信息 |
X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
Y | 原子半径为0.102 nm,其原子核外电子排布为: |
Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
W | 所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)W在元素周期表中的位置是 。
(2)Y与W相比,非金属性较强的是 (填元素符号),下列事实能证明这一结论的是 (填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z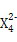 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z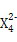 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明) 。
| 元素 | 有关信息 |
| X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
| Y | 原子半径为0.102 nm,其原子核外电子排布为: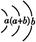 |
| Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W | 所在主族序数与所在周期序数之差为4 |
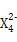 ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。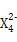 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。(8分)有关元素X、Y、Z、W的信息如下:
| 元素 | 有关信息 |
| X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: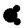 常温下是液体 常温下是液体 |
| Y | 原子半径为0.102 nm,其原子核外电子排布为: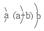 |
| Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
| W | 所在主族序数与所在周期序数之差为4 |
一、单项选择题(本题包括16小题,每小题3分,共48分)
1、B 2、D 3、B 4、A 5、D 6、A 7、A 8、C
9、B 10、A 11、C 12、B 13、B 14、B 15、B 16、D
二、(本题包括2小题,共40分)
17。(3分)①②⑤⑥
18.(13分)(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率(2分)
(2)①没道理,因为H2本身难溶于水(2分)
②(2分)
将铜片加入稀硫酸中,并微热
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(5分)
白色沉淀是氯化亚铜
向白色沉淀中加入稀HNO3等强氧化剂
溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾溶液
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
 (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
19.(12分)
(1) (2分)
(2分)
(2)Cl2+H2O2==2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O==2Al(OH)3↓+3H2Te↑(或其它合理答案(2分)
(5)Se(2分)O2(2分)
20.(12分)(1)使Al3+、Fe3+完全沉淀(2分)
(2)Ca2++(NH4) CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各2分,共4分)
三、(本题包括1小题,共12分)
21。⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x =
 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) =
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(各2分,共12分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com