
题目列表(包括答案和解析)
一混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后,测得A的浓度为0.5mol/L,当在恒温下将密闭容器的容积扩大1倍再达平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是( )
zC(g),达到平衡后,测得A的浓度为0.5mol/L,当在恒温下将密闭容器的容积扩大1倍再达平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是( )
A.x+y>z
B.平衡向右移动
C.B的转化率升高
D.A的物质的量减少
| A.x+y>z | B.平衡向右移动 |
| C.B的转化率升高 | D.A的物质的量减少 |
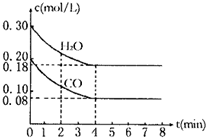
 CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:| T℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.m+n>p?
B.A的转化率降低?
C.平衡向逆反应方向移动
D.C的体积分数增加
一、单项选择题(本题包括16小题,每小题3分,共48分)
1、B 2、D 3、B 4、A 5、D 6、A 7、A 8、C
9、B 10、A 11、C 12、B 13、B 14、B 15、B 16、D
二、(本题包括2小题,共40分)
17。(3分)①②⑤⑥
18.(13分)(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率(2分)
(2)①没道理,因为H2本身难溶于水(2分)
②(2分)
将铜片加入稀硫酸中,并微热
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
(3)(5分)
白色沉淀是氯化亚铜
向白色沉淀中加入稀HNO3等强氧化剂
溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾溶液
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是
 (4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
(4)[CuCl4]3-(aq) CuCl(s) +
3Cl-(aq) (2分)
19.(12分)
(1) (2分)
(2分)
(2)Cl2+H2O2==2HCl+O2(2分)
(3)-2、+4、+6(2分)
(4)Al2Te3+6H2O==2Al(OH)3↓+3H2Te↑(或其它合理答案(2分)
(5)Se(2分)O2(2分)
20.(12分)(1)使Al3+、Fe3+完全沉淀(2分)
(2)Ca2++(NH4) CaC2O4↓+2NH4+(2分)
(3)Fe(OH)3、Al(OH)3(各1分,共2分)
(4)Fe3++3SCN― Fe(SCN)3(写成其它正确的络合离子形式给分,2分)
(5)使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在。(各2分,共4分)
三、(本题包括1小题,共12分)
21。⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x =
 解法二: N2 + 3H2 2NH3
解法二: N2 + 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16
⑵n平(NH3) =
⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
(各2分,共12分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com