
题目列表(包括答案和解析)
|
在反应中CaH2+2H2O=Ca(OH)2+2H2↑,下列叙述正确的是 ①H2是氧化产物 ②H2是还原产物 ③H2是氧化产物又是还原产物④CaH2中氢元素既被氧化又被还原 ⑤生成1 mol H2时,电子转移1 mol ⑥H2O是氧化剂 | |
| [ ] | |
A. |
②④⑤ |
B. |
③⑤⑥ |
C. |
①④⑥ |
D. |
②⑤⑥ |
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
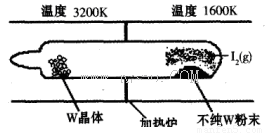
①反应(I)的平衡常数表达式K=_______,若K= ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
pH(25℃) | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示: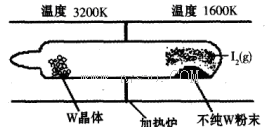
①反应(I)的平衡常数表达式K=_______,若K=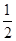 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中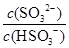 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
 WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示: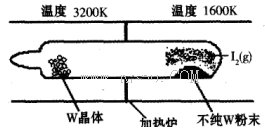
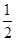 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
| 10-7y |
| x-y |
| 10-7y |
| x-y |
第Ⅰ卷
1.D 抗原的特异性取决于抗原决定簇。
2.A 减数第一次分裂时,同源染色体不分离,则产生的两个次级精母细胞的染色体数目全部不正常。而四分体的交又互换,跟染色体数目的异常变化投有关系,仅对遗传有意义;C、D项均可能导致产生染色体数目一半不正常的配子。
3.D 寒冷刺激时,甲状腺激素含量增多,A错;正常人空腹状态下口服一定量葡萄糖一段时间后,血糖含量仍应维持在100mg/dL左右,B错;进食后随血糖浓度的变化,人体内胰岛素的降血糖作用和胰高血糖素的升血糖作用相互抵抗,共同实现对糖代谢的调节,C错。
4.B 等位基因是通过基因突变产生的。在自然情况下,只有生殖细胞发生的突变才可传递给后代,而造血干细胞属于体细胞。不同的基因其碱基对的序列不同,也包括所含外显子和内含子数目的差异。D中基因的非编码区在基因的表达中起调控作用,是不可缺少的。
5.C 图示三个种群之间的关系为捕食关系;该生态系统中的食物链含解析.files/image323.gif) ;三个种群的数量变化均表现为S型增长曲线;种群a在第3~6年间大幅度增加个体数,使种群b个体被大量捕食,同时因环境发生变化,种群c个体数急剧减少,加剧了种群b的种内斗争。
;三个种群的数量变化均表现为S型增长曲线;种群a在第3~6年间大幅度增加个体数,使种群b个体被大量捕食,同时因环境发生变化,种群c个体数急剧减少,加剧了种群b的种内斗争。
6.B Fe属于Ⅶ族;P比含解析.files/image325.gif) 的非金属性强,
的非金属性强,含解析.files/image009.gif) 比
比含解析.files/image007.gif) 稳定;
稳定;含解析.files/image329.gif) 和
和含解析.files/image325.gif) 均处于第四周期;同位素是同一种元素的不同核素之间的互称。
均处于第四周期;同位素是同一种元素的不同核素之间的互称。
7.D 该有机物可能是氨基酸、硝酸酯、硝基化合物等,故A、B项均可能正确;H原子数为奇数时,该有机构的相对分于质量为奇数,C正确;由价键理论可知,氢原子数与氮原于数之和必为偶数,故D项不正确.
8.C C项应为含解析.files/image332.gif) ==
==含解析.files/image334.gif) 。
。
9.B 含解析.files/image043.gif) 为离子化合物,没有共用电子对,A错;C项中转移电子效应为4
为离子化合物,没有共用电子对,A错;C项中转移电子效应为4含解析.files/image041.gif) ,错;1 mol
,错;1 mol 含解析.files/image057.gif) 中含电子数为8
中含电子数为8含解析.files/image041.gif) ;B项中,
;B项中,含解析.files/image339.gif)
10.B 电解含解析.files/image060.gif) 和
和含解析.files/image064.gif) 溶液,pH均增大;电解
溶液,pH均增大;电解含解析.files/image062.gif) 溶液,pH减小;电解
溶液,pH减小;电解含解析.files/image066.gif) 溶液,pH不变。
溶液,pH不变。
含解析.files/image345.gif) ,A正确;对
,A正确;对含解析.files/image068.gif) 溶液,
溶液,
由电荷守恒有:含解析.files/image348.gif) ,
,
由物料守恒有;含解析.files/image350.gif) ,结合二者可推知 B、C正确;D项中未指明两溶液体积,仅当两溶液体积相等时pH相等,错误。
,结合二者可推知 B、C正确;D项中未指明两溶液体积,仅当两溶液体积相等时pH相等,错误。
12.D 该反应不一定为可逆反应,若Y已消耗完,X的浓度也不改变。
13.B 被还原的硝酸的物质的量等于消耗的硝酸根离子的物质的量,
1.0 mol-0.75 mol=0.25 mol。
14.A 由含解析.files/image352.gif) 得
得含解析.files/image354.gif) ,所以
,所以含解析.files/image356.gif) ,A项正确。
,A项正确。
15.B 含解析.files/image098.gif) 激发态的氢原子跃迁到
激发态的氢原子跃迁到含解析.files/image100.gif) 激发态时发射出的是红光,处于
激发态时发射出的是红光,处于含解析.files/image102.gif) 激发态的氢原子发生跃迁发射出光子的频率一定比红光的频率大,由电磁波谱图知A错误;伦琴射线产生的机理是原子的内层电子受到激发后产生的,
激发态的氢原子发生跃迁发射出光子的频率一定比红光的频率大,由电磁波谱图知A错误;伦琴射线产生的机理是原子的内层电子受到激发后产生的,含解析.files/image104.gif) 射是原于核受到激发后产生的,与题意不符,故只有B项正确。
射是原于核受到激发后产生的,与题意不符,故只有B项正确。
16.AB 由含解析.files/image362.gif) 可知,
可知,含解析.files/image109.gif) 的位置不动时,副线圈两端电压不变,由
的位置不动时,副线圈两端电压不变,由含解析.files/image365.gif) 可知,
可知,含解析.files/image113.gif) 增大,
增大,含解析.files/image368.gif) 减小,故A项正确,
减小,故A项正确,含解析.files/image370.gif) 的电功率
的电功率含解析.files/image372.gif) 也减小,故B项正确;当
也减小,故B项正确;当含解析.files/image113.gif) 的阻值不变,
的阻值不变,含解析.files/image109.gif) 向上滑时,副线圈两端电压减小,所以电流表的读数减小,C项错误;
向上滑时,副线圈两端电压减小,所以电流表的读数减小,C项错误;含解析.files/image111.gif) 的功率
的功率含解析.files/image376.gif) 也减小,故D项也错误。
也减小,故D项也错误。
17.B 当突然撤去钉后,活塞受到弹簧向右的弹力含解析.files/image378.gif) 和气体向左的压力
和气体向左的压力含解析.files/image380.gif) 作用,若
作用,若含解析.files/image382.gif) ,则活塞向右移动,气体体积减小,压强增大,由热力学第一定律知气体的内能增大;若
,则活塞向右移动,气体体积减小,压强增大,由热力学第一定律知气体的内能增大;若含解析.files/image384.gif) ,则气体内能减小;若
,则气体内能减小;若含解析.files/image386.gif) ,则气体的内能不变。若活塞移动再次静止时,在前两种情况中,弹簧有形变,故A、C、D项错误,B项正确。
,则气体的内能不变。若活塞移动再次静止时,在前两种情况中,弹簧有形变,故A、C、D项错误,B项正确。
18.B 由图可知,三个带电粒子在匀强磁场中做匀速圆周运动的轨道半径不同,含解析.files/image388.gif) ,又由
,又由含解析.files/image390.gif) ,可得
,可得含解析.files/image392.gif) ,所以
,所以含解析.files/image129.gif) 粒子的动能最大,故A项错误,B项正确;又由
粒子的动能最大,故A项错误,B项正确;又由含解析.files/image395.gif) ,可知三个粒子在匀强磁场中运动的周期相等,故D项错误,又因三段圆弧中
,可知三个粒子在匀强磁场中运动的周期相等,故D项错误,又因三段圆弧中含解析.files/image129.gif) 所对的圆心角最小,所以
所对的圆心角最小,所以含解析.files/image129.gif) 粒于在磁场中运动时间最短,故C项错误。
粒于在磁场中运动时间最短,故C项错误。
19.BC “嫦娥一号”在远月点对月球的万有引力为含解析.files/image397.gif) ,故A项错误,B项正确;又在月球表面有
,故A项错误,B项正确;又在月球表面有含解析.files/image399.gif) ,得
,得含解析.files/image401.gif) 代人
代人含解析.files/image403.gif) 得
得含解析.files/image405.gif) ,故C项正确,又卫星挠月球沿椭圆轨道运行,故D项错误。
,故C项正确,又卫星挠月球沿椭圆轨道运行,故D项错误。
20.A 由图可知小三角形的边长为含解析.files/image407.gif) ,它的面积为
,它的面积为含解析.files/image409.gif) ,当导线框匀速转动
,当导线框匀速转动含解析.files/image411.gif) 时,穿过导线框的磁通量改变了
时,穿过导线框的磁通量改变了含解析.files/image413.gif) Ф=
Ф=含解析.files/image415.gif) ,所以平均感应电动势,
,所以平均感应电动势,含解析.files/image417.gif) ,故A项正确。B项错误;由楞次定律可判定导线框中感应电流方向为
,故A项正确。B项错误;由楞次定律可判定导线框中感应电流方向为含解析.files/image419.gif) ,故C、D项均错误。
,故C、D项均错误。
21.C 木板条先做初速度为零的匀加速直线运动,加速度大小为含解析.files/image421.gif)
含解析.files/image423.gif) 。因为加速到速度和两条边缘的线速度相等时,向左通过的位移为
。因为加速到速度和两条边缘的线速度相等时,向左通过的位移为含解析.files/image425.gif)
含解析.files/image427.gif)
含解析.files/image429.gif) s,匀速运动的时间为
s,匀速运动的时间为含解析.files/image431.gif) ,总时间为1.5s,故C项正确。
,总时间为1.5s,故C项正确。
第Ⅱ卷
22.(1)①20.7(3分) ②含解析.files/image433.gif) (3分)
③低电压(3分)
(3分)
③低电压(3分)
(2)①FBACED(4分) ②2400含解析.files/image204.gif) (2分)
大于(2分)
(2分)
大于(2分)
23.(1)由于小孩无碰撞进入圆弧轨道,即小孩落到含解析.files/image188.gif) 点时速度方向沿
点时速度方向沿含解析.files/image188.gif) 点切线方向,则
点切线方向,则含解析.files/image438.gif) 53° (2分)
53° (2分)
又由含解析.files/image440.gif) 得
得含解析.files/image442.gif) (3分)
(3分)
而含解析.files/image444.gif) m/s (2分)
m/s (2分)
联立以上各式得含解析.files/image446.gif)
(2)设小孩到最低点的速度为含解析.files/image448.gif) ,由机械能守恒,
,由机械能守恒,
有含解析.files/image450.gif) (3分)
(3分)
在最低点,据牛顿第二定律,
有含解析.files/image452.gif) (3分)
(3分)
代人数据解得含解析.files/image454.gif) N
N
由牛顿第三定律可知,小孩对轨道的压力为615 N (2分)
24.解:(1)当环下落0.
含解析.files/image456.gif) (2分)
(2分)
此时含解析.files/image144.gif) 上升的高度为
上升的高度为含解析.files/image459.gif) m=0.
m=0.
含解析.files/image144.gif) 重力势能增加量为
重力势能增加量为含解析.files/image461.gif) (2分)
(2分)
此时两物体的速度均为零.由机械能守恒得
含解析.files/image463.gif) =
=含解析.files/image465.gif) (2分)
(2分)
所以含解析.files/image467.gif) =2:1 (2分)
=2:1 (2分)
(2)当环下落O.含解析.files/image144.gif) 上升高度
上升高度含解析.files/image470.gif) m=
m=含解析.files/image472.gif) m
m
(2分)
由机械能守恒得含解析.files/image474.gif) (3分)
(3分)
含解析.files/image476.gif) 之间的关系为:将环向下的速度
之间的关系为:将环向下的速度含解析.files/image220.gif) 分解为沿绳子方向和垂直绳子方向。
分解为沿绳子方向和垂直绳子方向。
沿绳子方向的分速度即为含解析.files/image144.gif) 上升的速度。
上升的速度。
所以有含解析.files/image480.gif) (2分)
(2分)
解以上各式得:含解析.files/image482.gif) m/s (1分)
m/s (1分) 含解析.files/image484.gif) m/s (1分)
m/s (1分)
25.解:(1)带电系统开始运动时,设加速度为含解析.files/image486.gif) ,由牛顿第二定律:
,由牛顿第二定律:
含解析.files/image488.gif) ① (2分)
① (2分)
球含解析.files/image158.gif) 刚进入电场时,带电系统的速度为
刚进入电场时,带电系统的速度为含解析.files/image220.gif) ,有:
,有:
含解析.files/image492.gif) ② (2分)
② (2分)
由①②求得:含解析.files/image494.gif) ③ (1分)
③ (1分)
(2)带电系统的运动为住复运动
设球含解析.files/image158.gif) 从静止到刚进入电场的时间为
从静止到刚进入电场的时间为含解析.files/image496.gif) ,则:
,则:含解析.files/image498.gif) ④ (1分)
④ (1分)
将①、③代人④得:含解析.files/image500.gif) ⑤ (1分)
⑤ (1分)
球含解析.files/image158.gif) 进入电场后,带电系统的加速度为
进入电场后,带电系统的加速度为含解析.files/image502.gif) ,由牛顿第二定律:
,由牛顿第二定律:
含解析.files/image504.gif) ⑥ (2分)
⑥ (2分)
显然,带电系统做匀减速运动,设球含解析.files/image188.gif) 刚达到右板板时的速度为
刚达到右板板时的速度为含解析.files/image223.gif) ,减速所需时间为
,减速所需时间为含解析.files/image508.gif) ,则有
,则有含解析.files/image510.gif) L ⑦ (2分)
L ⑦ (2分)
含解析.files/image512.gif) ⑧ (1分)
⑧ (1分)
求得:含解析.files/image514.gif) ,
,含解析.files/image516.gif) ⑨ (2分)
⑨ (2分)
球A离电场后,带电系统继续做减速运动,设加速度为含解析.files/image518.gif) ,再由牛顿第二定律:
,再由牛顿第二定律:
含解析.files/image520.gif) ⑩ (2分)
⑩ (2分)
设球A从离开电场到静止所需的时间为含解析.files/image496.gif) ,则有:
,则有:
含解析.files/image523.gif) ⑾ (1分)
⑾ (1分)
求得:含解析.files/image525.gif) ⑿ (1分)
⑿ (1分)
含解析.files/image527.gif) (2分)
(2分)
26.(1)含解析.files/image529.gif) (2分)
第3周期、ⅥA族(2分)
(2分)
第3周期、ⅥA族(2分)
(2)含解析.files/image531.gif) (3分)
(3分)
(3)含解析.files/image533.gif) (2分)
(2分)
(4)含解析.files/image535.gif) (3分)
(3分)
(5)醋酸铵(或乙酸铵)(3分)
27.(1)含解析.files/image537.gif) (3分)
(3分) 含解析.files/image539.gif) (2分) 焰色反应(2分)
(2分) 焰色反应(2分) 含解析.files/image541.gif) 、
、含解析.files/image543.gif) (2分)
(2分)
(2)①含解析.files/image545.gif) (3分) ② 10:15:4(3分)
(3分) ② 10:15:4(3分)
28.(1)乙(2分) 红色固体完全溶解形成蓝色溶液,试管口有红棕色气体出现(2分)
(2)含解析.files/image547.gif) (2分)
(2分) 含解析.files/image549.gif) (2分)
(2分)
C <(9b-a)/8 (3分) 4 (2分)
(3)ABD(2分)
29. (1)含解析.files/image551.gif) (2) 4
(2) 4
(3)①含解析.files/image553.gif)
含解析.files/image554.gif) ②
②
醋化反应或取代反应(每空3分)
30 . ( 22分)
Ⅰ.(共8分)( 1 )线位体(2 分) 无氧呼吸(2 分)
( 2 )太阳能→(植物)电能→NADPH 和ATP 中活跃的化学能→有机物中稳定的化学能→(人体)ATP 中不稳定的化学能→机械能(肌肉收缩) (共4 分,写出植物体内或人体内的能量转移过程各给3 分.未答到“ATP”的扣l 分,未答到”电能”或“NADPH”的均扣1 分。未答到“活跃”或“稳定”等不扣分)
Ⅱ.(共14分)(l)种群密度(答“密度”也给满分1分)
( 2 )第二步:孤立性蝗虫2置于开放的黑色玻璃容器中,容器外放置孤立性蝗虫4(使蝗虫不能相互看到)(2分)
预期实验结果及结论:
②A与B均不表现出较明显的合群性行为,证明视觉、嗅觉两种刺激都不是有效的合群性触发因素。(3分)
③A表现出较明显的合群性行为,B不表现出较明显的合群性行为,证明视觉是较嗅觉刺激更为有效的合群性触发因素。(3 分)
问题探讨:
a .神经――体液调节(答“神经――体液调节”也给满分2 分)
b .不能(l 分)缺乏雄性实验组;缺乏重复实验;每组实验用的蝗虫个体数较少(答出其中一点即给满分2 分)
31 . (20分)
Ⅰ.( 共8分)维管束鞘(1分)
CO2(2分) 四碳(或含解析.files/image556.gif) )(2分)
)(2分)
(2)酵母菌(l分)过滤、沉淀(共2 分,写出一个给1分)
Ⅱ.(共12分)(1)①3/32(2分)
②第一步:选择亲本中多对雌雄个体进行杂交,产生后代含解析.files/image558.gif) (3分)
(3分)
第二步:选择含解析.files/image558.gif) 中的棕色猪与白色异性猪杂交,后代不出现性状分离,其亲本即为纯合(3分,如答
中的棕色猪与白色异性猪杂交,后代不出现性状分离,其亲本即为纯合(3分,如答含解析.files/image558.gif) 中的棕色猪与棕色猪杂交不给分)
中的棕色猪与棕色猪杂交不给分)
(2)如果这种牛在长期繁殖过程中.从未出现过矮脚牛,那么这头矮脚牛的产生,可能是基因突变的直接结果。否则,可能是由于它的双亲都是隐性矮脚基因的携带者。
或答:调查这个牛群中,原来有没有出现过矮脚牛,如果有过。那就是隐性基因携带者造成的结果;如果从没有出现过矮脚牛.那么就是基因突变的结果。
或答:调查这个牛群在长期繁殖过程中,有没有再出现过矮脚牛。如果再出现过,那就是隐性基因携带者造成的结果;如果再没有出现过矮脚牛,那么就是基因突变的结果。(4分,本题要求设计一个调查方案,答杂交方案不给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com