
题目列表(包括答案和解析)
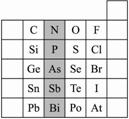
(1)根据元素周期律,请你预测:H3AsO4、H3PO4的酸性强弱:H3AsO4________(用“>”“<”或“=”表示)H3PO4。
(2)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”“更小”或“相同”)________。
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式
(4)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为_________ ;
(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(1)阴影部分元素N的最高价氧化物为 。根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,
(3)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构。请写出羰基硫分子的电子式
(4)单质砷和热的浓H2SO4反应,生成As2O3,反应的化学方程式为_________ ;
一.选择题(48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
A
C
B
C
B
B
题号
9
10
11
12
13
14
15
16
答案
A
D
C
C
B
B
D
A
二.非选择题(52分)
17.(1) .
. (2)
(2) .
. (3)
(3)
(4) (每空2分,答错或少答1个扣1分,扣到0分为止)
(每空2分,答错或少答1个扣1分,扣到0分为止)
18.(1)验证锂.钠.钾的活泼性(或同一主族,从上到下元素的金属性逐渐增强)(2分);c(1分)
(2)① (各1分)
(各1分)
② (或
(或 (2分)
(2分)
19.(1)第三周期 ⅦA(1分)
(2) 氯碱(2分)
氯碱(2分)

(3)
(4) ;
; KJ/mol(2分)
KJ/mol(2分)
或 ;
; KJ/mol
KJ/mol
(5)离子晶体(1分)
20.(1)硫  离子键.非极性键(4分)
离子键.非极性键(4分)
(2) (2分)
(2分)
(3)① (2分)
(2分)
② (2分)
(2分)
21.(1)
(2)分液漏斗(1分)
(3)饱和食盐水(或饱和氯水)(1分)浓硫酸(1分)
(4) (1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(1分)酒精(汽油.苯等有机溶剂或其他合理答案)(1分)
(5)使生成的 升华,与其他固体分离(2分)
升华,与其他固体分离(2分)
(6)吸收多余的 ,防止污染空气(1分)
,防止污染空气(1分)
(7)连接 的导管易被
的导管易被 固体堵塞(2分)
固体堵塞(2分)
22.(1)0.16 (2)0.03 0.05 (3)5.72
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com