
题目列表(包括答案和解析)
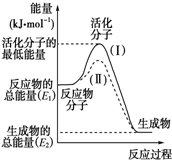 (1)图中所示反应是
(1)图中所示反应是| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题. 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题: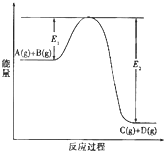 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.(6分)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
(1)据图判断该反应是___①___(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__②__ (填“增大”、“减小”或“不变”)
(2)其中B历程表明此反应采用的条件为___③___ (选填下列序号字母),作出正确的判断的理由为__④____
A、升高温度 B、增大反应物的浓度 C、降低温度 D、使用了催化剂
(3)若△H的数值为200KJ/mol,则此反应在A反应历程中的正反应的活化能为___⑤___KJ/mol,x值应为 ___⑥___KJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com