
题目列表(包括答案和解析)
| |||||||||||||||||||||||
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示。则:
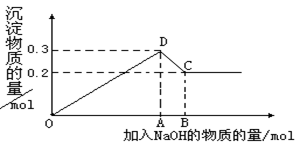
(1)写出DC段发生反应的离子方程式:
___________________ 。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经转化为 ,Mg2+已经转化为 。
(4)图中线段OA∶AB= 。
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示.则:
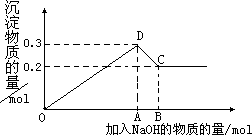
(1)写出代表各线段发生反应的离子方程式:
OD段________.________,
DC段________.
(2)原溶液中Mg2+.Al3+物质的量浓度之比为________.
(3)图中C点表示当加入________mol NaOH时,Al3+已经转化为________,Mg2+已经转化为________.
(4)图中线段OA∶AB=________.
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示.则:
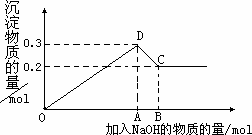
(1)写出代表各线段发生反应的离子方程式:
OD段________,
DC段________.
(2)原溶液中Mg2+、Al3+物质的量浓度之比为________.
(3)图中C点表示当加入________mol NaOH时,Al3+已经转化为________Mg2+已经转化为________.
(4)图中线段OA∶AB=________.
 五、19、(10分)(1)
(2分)
五、19、(10分)(1)
(2分)
(2)Na+ (2分)
(3)由于HF中含有以氢键相结合的聚合氟化氢分子(HF)n (3分),(其它合理答案参考给分)
(4)Na3AlF6 (3分)
20、(10分) (1) 减小 (2分) (2) 1 (2分)
(3) 正确(1分) 2 molX和1 molY不可能完全反应 (1分)
(4) A (2分,有错不给分)
(5)  (2分)
(2分)
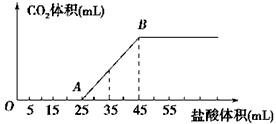
六、21、(10分)(1)H+ + OH― = H2O, CO32― + H+ = HCO3― (4分)
(2)224mL(2分)
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
 x + y = 1mol/L×(0.045-0.025)L
x + y = 1mol/L×(0.045-0.025)L
z - y = 1mol/L×[0.025-(0.045-0.025)]L
x=0.01mol,y=0.01mol,z=0.015mol
所以,NaOH的质量为:0.015mol
*
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com