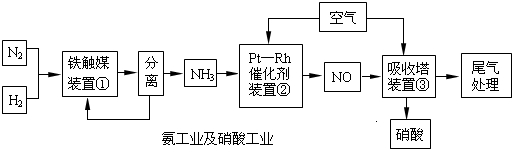
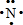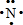(2011?沈阳二模)短周期元素X、Y、Z,Z是自然界中原子半径最小的元素;单质X
2与Y
2在放电的条件下反应生成A;X、Y、Z可以形成的化合物有 ZXY
3、XZ
4XY
3等.
(1)写出X原子的电子式
,画出Y的原子结构示意图
.
(2)写出X
2与Z
2化合生成XZ
3的化学方程式
.
(3)将ZXY
3的稀溶液和XZ
3溶液混合,不可能出现的结果是
AD
AD
.
A.pH<7,且c(H
+)>c(XY
3-)>c(OH
-)>c(XZ
4+)
B.pH<7,且c(XY
3-)+c(OH
-)=c (H
+)+c(XZ
4+)
C.pH>7,且c (XZ
4+)>c (OH
-)>c (XY
3-)>c (H
+)
D.pH=7,且c (XZ
4+)>c (XY
3-)>c (H
+)=c (OH
-)
(4)写出ZXY
3的稀溶液与过量铁粉反应的离子方程式
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
.
(5)当铜与ZXY
3的浓溶液反应时,为防止有毒气体逸出污染空气,可将尾气通入NaOH溶液中,反应生成两种盐(物质的量相同)和水.写出其化学方程式
2NO2+2NaOH=NaNO2+NaNO3+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
.