
题目列表(包括答案和解析)
(16分)某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
(1)步骤①中涉及的离子方程式有: 。
(2)步骤②中加入H2O2的目的是: 反应的离子方程式为 。
(3)已知:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |

已知:
| 氢氧化物开始沉淀时的pH | 氯氧化物沉淀完全时的pH |
Fe3+ | 1.9 | 3.2 |
Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是_____________________(填序号)
A.H2O2 B.KMnO
写出加入X后发生反应离子的方程式_____________________。
(2)加入的物质Y可以是,目的是________________________________________。
(3)某同学利用反应Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
设计实验来制取氯化铜溶液。该同学设计的装置应该为________________。(填“原电池”或“电解池”)。请在下侧方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
|
(4)从CuCl2稀溶液中得到CuCl2·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是________________________________。
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。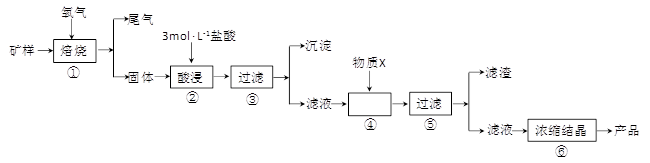
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

(15分)制取纯净的氯化铜晶体(CuCl2·2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2。
II.对I中所得到的溶液按下列步骤进行提纯。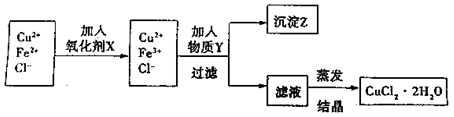
已知:
| | 氢氧化物开 始沉淀时的pH 始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
 。(填序号)
。(填序号) 。
。 ++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为 。(填“原电池”或“电解池”)
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体。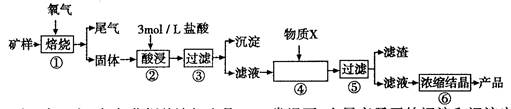
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com