
题目列表(包括答案和解析)
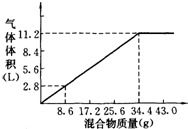 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算:
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算:盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:

(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
⑴.在100mL 1mol·L-1Al2(SO4)3溶液中,Al2(SO4)3电离方程式为: ,
则溶液中含Al3+离子 mol,含SO42-离子 个。
⑵.在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用(NH4)2SO4、KCl、NH4Cl配制,则所需的(NH4)2SO4、KCl这两种固体的物质的量分别为 、 (提示:离子守恒)
在100mL NaOH溶液中加入![]() 和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积
和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积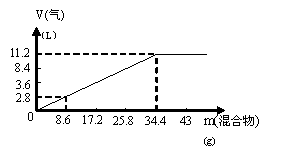
(标准状况)关系如图。当V(NaOH)=140mL时,固体混合物的质量是51.6g,充分反应后,生成气体的体积是(标准状况)
A. 7.84L
B. 8.4L
C. 15.68L
D. 16.8L
在100mL NaOH溶液中加入![]() 和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积
和(NH4)2SO4固体混合物,加热充分反应,加入的混合物的质量和产生的气体的体积
(标准状况)关系如图。当V(NaOH)=140mL时,固体混合物的质量是51.6g,充分反应后,生成气体的体积是(标准状况)
A. 7.84L
B. 8.4L
C. 15.68L
D. 16.8L
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
C
C
B
B
题号
9
10
11
12
13
14
15
16
17
18
答案
D
A
A
AB
AD
C
C
C
BC
C
19.A
20.①I-、Ba2+、NH4+
②Fe3+、NO3-、Mg2+、SO42-、CO32-、Al3+
③K+、Cl-
21.(1)C F G
(2)Fe3+ +3NH3H2O=Fe(OH)3 ↓+ 3 NH4+
(3)6Fe2+ + ClO3― + 6 H+ = 6Fe3+ + Cl― + 3H2O ,无影响,3:1
(4)坩埚
继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过
 (5)
(5) 4次
4次
×2× g×100%
g×100%
22.(1)H2O2溶液或H2O,少量的MnO2粉末或Na2O2;C。
(2)排水法收集--广口瓶中盛满水 , NO 从 d 管通入
(3)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色(黄色)
23.4NxHy+yO2 →2xN2+2yH2O 反应前后质量守恒,同温同压下气体密度与气体体积成反比 x=2,y=4 N2H4

24.(1)n(NaClO)┱n(NaClO3)=1┱2
(2)7Cl2+14NaOH=NaClO+2NaClO3+11NaCl+7H2O
(3)c(NaClO)=0.2mol/L
c(NaClO3)=0.4moL/L c(NaCl)=2.2mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com