
题目列表(包括答案和解析)
| KMnO3/H+ |
| 浓硫酸 |
| △ |
 nCH=CH+nCH=CH
nCH=CH+nCH=CH| 催化剂 |





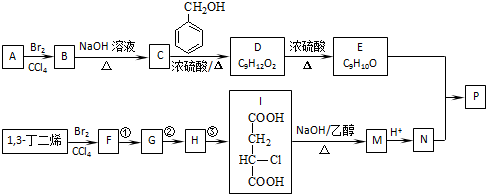
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
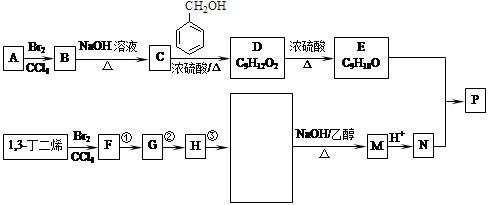
已知:
R—CH2OH R—COOH(R表示饱和烃基)
R—COOH(R表示饱和烃基)
|
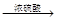 R—O—R′+H2O (R、R′ 表示烃基)
R—O—R′+H2O (R、R′ 表示烃基)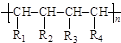
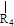
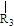
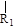 nCH=CH+nCH=CH
nCH=CH+nCH=CH (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)
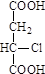
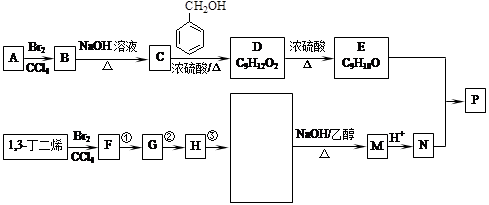
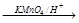 R—COOH(R表示饱和烃基)
R—COOH(R表示饱和烃基)
|
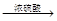 R—O—R′+H2O (R、R′ 表示烃基)
R—O—R′+H2O (R、R′ 表示烃基)
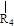
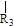
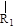 nCH=CH+nCH=CH
nCH=CH+nCH=CH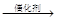 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)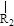
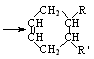 (可表示为
(可表示为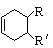 )其中,R、R′表示原子或原子团。A、B、C、D、E、F分别代表一种有机物,F的相对分子质量为278,其转化关系如下图所示(其它反应物、产物及反应条件略去):
)其中,R、R′表示原子或原子团。A、B、C、D、E、F分别代表一种有机物,F的相对分子质量为278,其转化关系如下图所示(其它反应物、产物及反应条件略去): 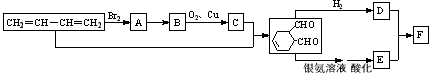
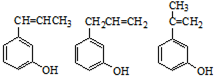
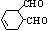 中含氧官能团的名称是____________________。
中含氧官能团的名称是____________________。 (14分)现有6种短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质为空气的主要成分 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有 个电子;元素X的一种核素可测定文物年代,这种核素的
符号是 。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应 _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是 ,下列表述中能证明这一事实的
是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价
氧化物的水化物中,化学性质明显不同于其他三种的是 (用分子式表示),
理由是 。
6―10 ACCAC 11―13 BDD
25.(13分)Ⅰ(1)H2NCH2―(CHNH2)4―CH=NH;
HOCH2―COOH或H2N―CH2COOH(2×3′)
 |
Ⅱ89.6(3′) (2)4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑(4′)
26.(15分)(1)C Na
 (2)Na2CO3+2HCl=2NaCl+CO2↑+H2O
(2)Na2CO3+2HCl=2NaCl+CO2↑+H2O
(3)Na+[∶O∶O∶]2―Na+
(4)2Na2O2+4H2O+2S2―=2S↓+4Na++8OH―(每空3分)
27.(17分)(1)①

(以下每空2分)
②打开分液漏斗上口的活塞,旋开分液漏斗的活栓,缓慢滴加。
(2)①SO2+Br2+2H2O=4H++2Br―+SO42―
②有浅黄色沉淀(或溶液变浑浊)
(3)①Na2SO3变质,取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明Na2SO3变质。
②不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸(其它合理方法也可)
28.(15分)(1)醛基(1分) (2)C14H18O(2分) a(1分) (3)醇(2分)

(4)
 |
(5)
 |
|