B.聚合氯化铝(PAC)可以看成是AlCl
3水解成为Al(OH)
3的中间产物,其化学通式为[Al
2(OH)
nCl
6-n]m(m≤10,n=3~5).若式中,n接近于6或等于6,则可称为铝溶胶.聚合氯化铝是一种无机高分子混凝剂.某合作学习小组的同学在查阅文献资料后拟用不同的方法制备聚合氯化铝.
(1)甲组用凝胶-溶胶法,它们用结晶氢氧化铝、烧碱、CO
2及盐酸为试剂生产,其中涉及的氢氧化铝与烧碱反应的化学方程式为:
.
(2)乙组采用不足量酸溶法,原料主要是铝加工的下脚料铝屑、铝灰和铝渣等,反应原理为:2Al+(6-n)HCl+nH
2O=Al
2(OH)
nCl
6-n+3H
2↑.该制备方法工艺简单、成本低,利用本身是放热反应,故不需要加热,可能缺点有:
(列举一条).
(3)丙组拟用高岭土(Al
2O
3?2SiO
2?2H
2O)等为原料,经焙烧、盐酸浸取、聚合、熟化、蒸发、干燥等步骤得到固体PAC.其中液体PAC蒸发时,适宜在110℃左右,你认为适宜的加热方法是
.
(4)丁组同学对甲、乙、丙组同学制得的样品进行定性实验,请你补充下列实验报告
| 实验序号 |
实验步骤 |
实验现象 |
结论 |
| ① |
用激光笔照射甲组制得的PAC溶液 |
光亮的通路 |
|
| ② |
取乙组制得的样品少许加入铝试剂阿罗明拿 |
变成玫瑰红色 |
|
| ③ |
取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
|
|
(5)戊组同学对丙组固体样品请质检部门用
27Al-NMR测试,其中的分散质主要是:Al
13O
4(OH)
24Cl
7,属于优质产品.他们另取样品mg少许放在坩埚中充分加热并灼烧,最终得到的固体产物为:
,若得到固体ng,则制得的样品中铝的质量分数为
.

 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.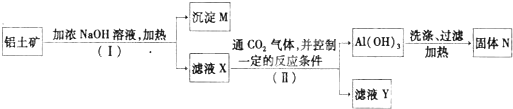
 (2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.

 Al(OH)3+3HCl
Al(OH)3+3HCl Al(OH)3+3HCl
Al(OH)3+3HCl