
题目列表(包括答案和解析)
| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
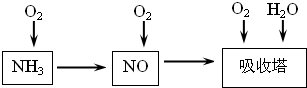
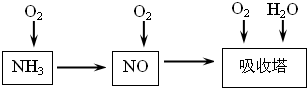
 2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)
2NH3,该反应在固定容积的密闭容器中进行.下列各项标志着该反应达到化学平衡状态的是______(填序号)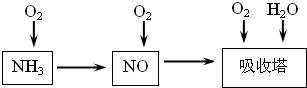
| ||
| 高温高压 |

| | 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |

 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
1-5ABCBD
30.I。光照强度,温度,降低,降低
II.(2)用黑纸遮光,在适宜的温度条件下放置一段时间。(2分)观察水体变成淡黄色。(2分)
(3)把水体变黄的试管放在日光灯下,在适宜的温度条件下放置一段时间观察水体颜色变化,(2分)水体恢复成淡紫色。(2分)
分析预测的结果:
(1)遮光条件下,植物只能进行呼吸作用,随着水体中二氧化碳浓度的增加,pH值下降.水体变成淡黄色.由此验证植物的呼吸作用释放二氧化碳.(2分)
(2)光照条件下,植物的光合作用强于呼吸作用,随着水体中二氧化碳浓度的减少,pH值回升,水体又恢复成淡紫色.由此验证植物的光合作用吸收了二氧化碳。(2分)
(1)不放金鱼藻的水体(2分)
(2)温度、光强、金鱼藻数量(2分)
31.I (除注明外,每空1分,(1)红眼BbXaXa 2/3
(2)有丝分裂后 R或r
(3)①不可遗传变异
②实验步骤,第一步:用该未知基因型的黄色果蝇与正常黄色果蝇yy交配
第二步:将孵化出的幼虫放在不含银盐的饲养条件下培养,其他条件适宜
结果预测:如果后代出现了褐色果蝇,则所检测果蝇为“表型模拟”;如果子代全为黄色,说明所测黄色果蝇的基因型是yy,不是“表型模拟”2分
II. (1) 9(1分)4(1分) 黄色圆粒:黄色皱粒:绿色圆粒:绿色皱粒=9:3:3:1(1分)基因自由组合(1分)
(2)、(3)各3分:图解2分,说明1分


(4)YyRrDd,YyrrDd(2分)
化学参考答案和评分意见
6B 7D
26.(15分)
(1)H 氧 (各2分,共4分)
(2) 或
或
 (或其它合理答案) (各2分,共4分)
(或其它合理答案) (各2分,共4分)
(3) (3分)
(3分)
(4) (2分)
(2分)
(5) (2分)
(2分)
27. (13分)(1) 的电子式 (2分)
的电子式 (2分)
(2)① (2分)
(2分)
② (3分)
(3分)
(3) ;(3分)
;(3分)
 (3分)
(3分)
28(16分)(1)泥三角 干燥器(2分)
(2)C(2分)
(3)3CuSO4===3CuO+2SO2↑+SO3↑+O2↑(2分)
B装置的作用是吸收SO3 (2分) D装置的作用是除去SO2 (2分)
等到冷却后方可读数(2分)
O3 (2分)将褪色后溶液加热如恢复红色为SO2,如不恢复则为臭氧。(2分)
 29(16分)(1)C9H10O3(2分) A的一种可能结构为(2分)
29(16分)(1)C9H10O3(2分) A的一种可能结构为(2分)
羧基、羟基(2分)
 物理参考答案和评分意见
物理参考答案和评分意见
14.AD 15.A 16.A 17.B 18.BD 19.A 20.C21.AD
22. (17分) (1) 102.35,10.296;(2) (2)①C,②CD; (3) ①较大,②30
23. (16分) 解:(1)设力F作用时物体的加速度为a1,对物体进行受力分析,由牛顿第二定律可知 F-mgsinθ-μmgcosθ=ma1 (1分)
撤去力后,由牛顿第二定律有 mgsinθ+μmgcosθ=ma2 (1分)
由图可知:a1=
t1=1s时物体的速度:v1=a1t1 (1分)
拉力F的平均功率为P=Fv1/2 (1分)
解得P=300W (1分)
(2)设撤去力后物体运动到最高点时间为t2, v1=a2t2,解得t2=2s (2分)
则物体沿着斜面下滑的时间为t3=t-t1-t2=1s
设下滑加速度为a3,由牛顿第二定律 mgsinθ-μmgcosθ=ma3,a3=
t=4s时速度v=a3 t3=
24.(1)根据能量守恒:

(2)此时圆形金属圈切割磁场的有效长度L= m―(2分)
m―(2分)
 V ---(2分)
V ---(2分)
 V ---(4分)
V ---(4分)
(3)
 ------(2分)
------(2分)

 ------(3分) 方向向左 --------(1分)
------(3分) 方向向左 --------(1分)
 25. 解:(1)(6分)
25. 解:(1)(6分)
如上图,设粒子刚进入第一个有电场和磁场分布的区域时速度为v,由于qE=mg,所以粒子在里面作匀速圆周运动,设出第一个区域时与水平方向夹角为θ,则:
 vx=vcosθ 又
vx=vcosθ 又 即
即 代入得 vx=
代入得 vx= =
= =
=
(2)(7分)设粒子进入任意一个有电场和磁场分布的区域时速度为v,粒子作匀速圆周运动,设进入区域时与水平方向夹角为α,出区域时与水平方向夹角为β,则:
 ; 又
; 又
得
 =
= =
=
(3)(7分)设刚好能从第n个有磁场和电场的区域内射出(或不射出)
由能量关系有

在最低点,速度水平,即
 则
则 

故粒子不能穿过第61个有电场和磁场的区域
注意:此题也可以用微元的思想

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com