
题目列表(包括答案和解析)
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)已知反应N2(g)+3H2(g)2NH3(g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值: 。
化学键 | H—H | N—H | N=N |
键能(kJ/mol) | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:
C(s,石墨)+O2(g) CO2(g) △H1=-393.5kJ?mol-1 ①
2H2(g)+O2(g) 2H2O(1) △H2=-571.6kJ?mol-1 ②
2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l) △H3 =-2599kJ?mol-1 ③
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变: 。
在含有1.0 mol?L-1 的 Fe3+ 和 1.0 mol?L-1的Fe2+的溶液中加入KCN(s)有[Fe(CN)6]3-,[Fe(CN)6]4- 配离子生成。当系统中c (CN-) =1.0 mol?L-1 ,c ([ Fe (CN)6]3- = c ([ Fe (CN)6]4- = 1.0 mol?L-1时,计算E(Fe3+/ Fe2+)。
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
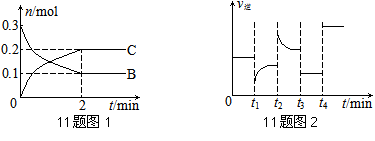
下列有关说法正确的是
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L?min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ?mol-1
(2)C(s)+O2(g)=CO2(g) △H2=-393.5kJ?mol-1
(3)H2(g)+![]() O2(g)=H2O(l) △H3=-285.8kJ?mol-1,
O2(g)=H2O(l) △H3=-285.8kJ?mol-1,
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的焓变△H为( )
A.488.3 kJ?mol-1 B.-244.15 kJ?mol-1
C.244.15kJ?mol-1 D.-488.3kJ?mol-1
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) === 2CO2(g)+2H2O(l) △H1= -870.3 kJ?mol-1
(2)C(s)+O2(g) === CO2(g) △H2= -393.5 kJ?mol-1
(3)H2(g)+![]() O2(g) === H2O(l) △H3= -285.8 kJ?mol-1
O2(g) === H2O(l) △H3= -285.8 kJ?mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的△H为( )kJ?mol-1
A.+488.3 B.-244.15 C.-488.3 D. +244.15
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com