
题目列表(包括答案和解析)

| ||
| ||
| 现象 | 结论与解释 | |
可能① |
||
可能② |
 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
| ||
| ||
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 | B、脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+ | C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-- | D、含有2.24g铁粉的脱氧剂,理论上最多能吸收氧气448mL(标准状况) |
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
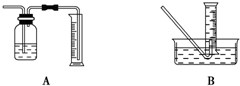
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
时(填实验现象),说明“铁与水蒸气”能够进行反应。
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称取一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率。
①收集并测量气体体积应选右图中的________装置(填A或B)。
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088g/L,最好选用 规格的量筒(选填字母序号)
A.100mL B.200mL C.500mL D.1000mL
③收集的气体体积为VL,铁粉的转化率为 。
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解、过滤。向滤液中滴加KSCN溶液,观察溶液的颜色。在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满)。
| | 现象 | 结论与解释 |
| 可能① | | |
| 可能② | | |
相对原子质量:H―1 O―16 Fe―56
一、选择题(只有一个选项符合题意,每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
C
D
B
C
A
A
D
C
C
A
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
B
C
C
C
D
A
C
B
A
D
D
B
二、填空题(共25分)
26. 不正确 ,将溶液稀释了,测定不准确
_碱__ 、 CO32?+ H2O →_HCO3- + OH? ____
27. 所加试剂 离子方程式
(3) Fe 、 2Fe3+ + Fe → 3Fe2+
(4) Cl2 、 2Fe2+ + Cl2 → 2Fe3+ + 2Cl?
28.(写化学式)A_ Fe _B __Cl2 __C H2 ___D FeCl3 E HCl F FeCl2
29. 溶液呈黄色 ; KSCN 红色 ; Fe3+
Fe3+ + 3SCN- → Fe(SCN)3 。
三、实验题(共12分)
30.(1) a e d b c f
(2) 干燥氯气 ;(3) 吸收尾气氯气 ;
(4) 用磁铁吸引产物,若被磁铁吸引,则含有铁 ;
(5) 否 ; 由于FeCl3 水解,加热蒸干该溶液只能得到Fe(OH)3
四、计算题(31题7分,32题6分,共13分)
31. 0.1233mol/L 32. (1) 0.01mol (2) 0.03mol (3) 2.4mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com