
题目列表(包括答案和解析)
 +Br2
+Br2| Fe |
 +HBr
+HBr +Br2
+Br2| Fe |
 +HBr
+HBr

 +3Br2→
+3Br2→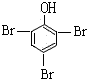 ↓+3HBr
↓+3HBr +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr

| ① | He-268.8 | Ne-249.5 | Ar(x) | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (a)58.7 | I2-184.0 |
| ③ | HF(Y) | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O(Z) | H2S-60.2 | (b)-42.0 | H2Te-1.8 |
有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.0 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列叙述中正确的是( )
A.a、b、c的化学式分别为Ne、Br2、HF
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
D.上表内物质HF和H2O,由于氢键的影响,其分子特别稳定
(10分)760℃和101.3kPa下,令氢气和氦气(体积比为1 :1)慢慢通过盛有熔融AgBr的舟皿,而使部分AgBr还原为Ag。然后让反应后的气体通过盛有40.00 mL 0.1000 mol?L-1NaOH的洗气瓶(溴单质被NaOH溶液吸收时,所生成的盐是两种强酸盐),并收集干燥后的尾气。某次实验后,洗气瓶内的溶液可以被l0.00 mL 0.1000 mol?L-1的HCl溶液中和,并在27.0℃ 101.3kPa下收集得干燥尾气492.4mL(已知760℃时纯HBr气体有16.67%分解为单质)。
(1)写出该实验过程中所发生的全部反应的方程式,并配平。
(2)计算舟皿中银单质的物质的量。
(3)计算尾气中氢气的物质的量。
有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如表所示:
|
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
D
D
D
C
A
D
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
A
C
B
A
D
B
C
B
D
21.(1)24FeSO4+30HNO3→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)FeSO4 +5价N (3) 得到 4
22.(1)>。在亚硫酸氢钠溶液中,存在HSO3-的电离平衡:HSO3-  H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O
H++SO32-,还有HSO3-的水解平衡:HSO3-+H2O H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
H2SO3+OH-。由题给信息[SO32-]>[H2SO3]可得出,其水解程度比电离程度弱,所以可确定[H+]>[OH-]。
 (2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
(2)含酚酞的氢氧化钠溶液的红色褪去,溶液呈无色。加入少量氢氧化钠溶液时,只有HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O。
23.(1) 0.01mol/L. min
(2) a=0.05 mol/L 图象如右
(3) BD
24.(1)Br2 ;Fe3+
(2)
乙 同学正确
选用试剂
实验现象
第一种方法
C
有机层无色
第二种方法
D
溶液变红
(3)Fe2+;不可以,因为Br2和Fe3+都能把I―氧化成I2
25.(1)b;
(2)将亚铁离子氧化为铁离子;
(3)除去过量的硫酸;不引入新的杂质;
(4)Fe3++3H2O=Fe(OH)3↓+3H+;(条件:加热)
(5)抑制Cu2+的水解;产生污染环境的二氧化硫,硫酸利用率低;加热,并在稀硫酸中通入氧气。(注:本题为发散性试题,如有其它合理答案,酌情给分)
 26.
26. ⑴ C6H5-CH-18OH CH3CH2- -18OH
⑴ C6H5-CH-18OH CH3CH2- -18OH

 ⑵C6H5-CH-18OH+HCOOH
⑵C6H5-CH-18OH+HCOOH HCO18O-CH-C6H5+H2O
HCO18O-CH-C6H5+H2O
⑶

计算题
27.(1)0.8mol/L (2)29.6%
附加题
1.B
2.C
3.(1)除去混在氢气中的酸性气体
(2)A B、C; 将E中的产生的硫酸亚铁溶液压入D中
(3)②
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com