
题目列表(包括答案和解析)
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
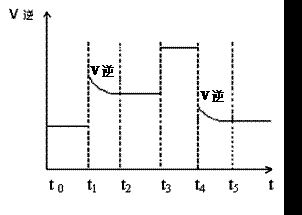
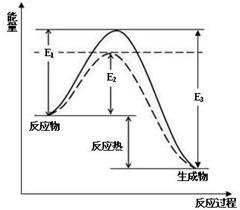
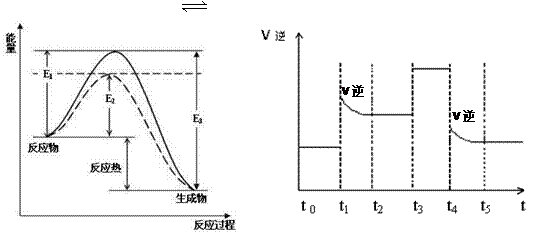
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
 可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)
(2) 图1中虚线部分是通过改变化学反应中的 条件,请解释原因
。
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀 较
完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为 (已知常温下,Fe(OH)3的
溶度积常数Ksp=4×10-38)
(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
| 状态 条件 | 起始时物质的物质的量(mol) | 平衡时NH3的物质的量 (mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒容 | ① | 1 | 3 | 0 | b |
| ② | 0 | 0 | | b | |
| ③ | | 2.25 | | b | |
在密闭容器中,保持一定温度进行如下反应N2(g)+ 3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。
(2)平衡常数K值越大,表明建立平衡时 (填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
| 状态 条件 | 起始时物质的物质的量(mol) | 平衡时NH3的物质的量 (mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒容 | ① | 1 | 3 | 0 | b |
| ② | 0 | 0 | | b | |
| ③ | | 2.25 | | b | |
在密闭容器中,保持一定温度进行如下反应N2(g)+ 3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a
mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a
mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。
(2)平衡常数K值越大,表明建立平衡时 (填字母序号)。
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表空格:
|
状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
|
编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
|
恒容 |
① |
1 |
3 |
0 |
b |
|
② |
0 |
0 |
|
b |
|
|
③ |
|
2.25 |
|
b |
一、选择题(共55分)(其中1―5每题2分共10分,6―20每题3分共45分)
1―5 BBCDB 6―10 DBBBA 11―15 BCBAB 16―20 CCCBD
二、填空题
21.(10分)(1)A:碳酸铵或碳酸氢铵(2分)
B:略 D:三角锥 G:红棕色(各1分)
(2)2CO2+2Na2O2=2Na2CO3+O2↑(2分)
(3)4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=+108akJ?mol-1(3分)
(1)4HCl(浓盐酸)+MnO2===MnCl2+2H2O+Cl2↑(2分)
.files/image022.gif) |
(2)2Cl2+2H2O(气)+C====4HCl↑+CO2↑(2分)
吸收Cl2中的HCl气体,提供D处所需水蒸气。(1分)
(3)生成的HCl气体使紫石蕊溶液变红,因未反应完的Cl2与H2O作用产生的HClO的漂白作用使红色消失。(2分)
(4)B(1分)
(5)瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2(2)
23.(11分)(1)0.93<x(Mg)<1.57,2,55<x(N)<3.44。(各2分)
(2)同周期(同主族)中,x值越大,其原子半径越小;(2分)周期性。(1分)
(3)氮原子(1分)
(4)共价键(2分)
(5)第六周期IA族(1分)
24.(9分)(1)正向(1分) (2)B、D(2分)
(3)①n(D)>0.6mol(2分)②n(C)=1.8mol n(D)>0.5mol(各2分)
三、计算题(5分)
26.(1)66.7% (2)50
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com